


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、R和Z形成的化合物属于共价化合物 |
| B、Y单质能在X的单质中燃烧,生成淡黄色物质Y2X2 |
| C、X、Z形成的化合物化学式为Z2X3,它属碱性氧化物 |
| D、在常温下,Z单质能溶于W的最高价氧化物对应水化物浓溶液中,生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
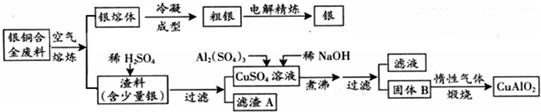
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中可能大量含有的离子如下表所示:
某混合溶液中可能大量含有的离子如下表所示:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
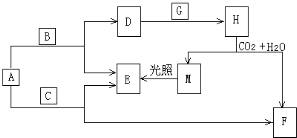
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com