
| A. | 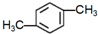 | B. | 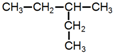 | C. | 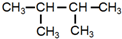 | D. | 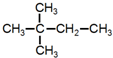 |
分析 有机物分子中含有4种等效氢原子,则其一氯代物就有4种,进行一氯取代反应后,就能够生成4种沸点不同的有机产物,以此解答该题.
解答 解:A. 中含有两种等效氢原子,其一氯代物只有2种,故A错误;
中含有两种等效氢原子,其一氯代物只有2种,故A错误;
B. ,该有机物分子中含有4种等效H原子,其一氯代物有4种,进行一氯取代反应后,只能生成4种沸点不同的有机产物,故B正确;
,该有机物分子中含有4种等效H原子,其一氯代物有4种,进行一氯取代反应后,只能生成4种沸点不同的有机产物,故B正确;
C.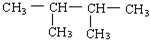 中只有2种等效氢原子,其一氯代物只有2种,故C错误;
中只有2种等效氢原子,其一氯代物只有2种,故C错误;
D.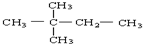 中含有3种等效氢原子,其一氯代物有3种,故D错误;
中含有3种等效氢原子,其一氯代物有3种,故D错误;
故选B.
点评 本题考查有机物的结构和性质,侧重考查了同分异构体的判断,题目难度不大,注意掌握同分异构体的概念及书写方法,明确互同分异构体的有机物分子之间沸点不同.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 取1 mol•L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液 | |
| D. | 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的电子排布式为1s22s22p63s23p6 | |
| B. | 26号元素的电子排布式为[Ar]3d64s2 | |
| C. | 基态C原子的轨道表示式为  | |
| D. | 基态N原子的轨道表示式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 利用乙烯和氯化氢在催化剂存在的条件下生成氯乙烷 | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和浓H2SO4反应制取Cu SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1,4-二甲苯)、
(1,4-二甲苯)、 (1,3,5-三甲苯).
(1,3,5-三甲苯).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X形成的单质一定是原子晶体 | |
| B. | X与Z形成的化合物具有熔点高、硬度大的特点 | |
| C. | Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:1 | |
| D. | W分别与Y、Z形成的化合物中含有的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 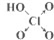 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com