
����Ŀ��һ�����������������ȵ��������dz����Ĵ�����Ⱦ�Ȼ�������ڹ�ҵ�����Ź㷺����;��
��֪���������£�2NO��Na2O2===2NaNO2��
�����������£�NO��NO2��������MnO��Ӧ����NO3����Mn2������5NO2����2MnO4����6H��===5NO3����2Mn2����3H2O��
��.��ľ̿��Ũ���ᡢˮ��ͭΪԭ�����ɵ�һ��������������Ʒ�Ӧ�Ʊ��������Ƶ�װ������ͼ��ʾ��
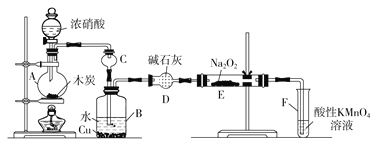
(1)A�й۲쵽��������_________________________________��
(2)B�з�Ӧ�����ӷ���ʽ��____________________��_______________________��
(3)װ��C��������___________________��װ��F��������__________________��
(4)����װ��D����E�в�������������⣬���и�����________(�ѧʽ)��
��.ij�о���ѧϰС���NO2��Na2O2�ܷ�����Ӧ����̽����
��������裩
����һ��NO2��Na2O2����Ӧ��
�������NO2�ܱ�Na2O2������
��������______________________________________________��
�����ʵ�飩
(1)ʵ��ʱ����NO2����ͨ��ʢ��Na2O2�IJ������У�����ɫ��ĩ��ȫ��ɰ�ɫ��˵������________��������
(2)���������������Ӧ�Ļ�ѧ����ʽ��_______________________��
(3)Ϊ��֤������Ƿ��������С��ͬѧ�������¶���ʵ���о���������±����ݡ�
ʵ�鲽��(��Ҫ��д����������̣��Լ���������ѡ) | Ԥ�ڵ�ʵ�������� |
ȡ�����İ�ɫ���������Թ��У�������ˮ�ܽ⣬_________________________ | _______________________________ |
���𰸡� �к���ɫ�������� 3NO2��H2O===2H����2NO3����NO�� 3Cu��8H����2NO3��===3Cu2����2NO����4H2O ��ֹ���� ����δ��Ӧ��NO Na2CO3��NaOH NO2�ܱ�Na2O2��ԭ һ 2NO2��Na2O2===2NaNO3 �������10���ٵμ�ϡ�����ữ�����μӸ��������Һ �����������Һ����ɫ�������������������������Һ��ɫ��������������(����������Ҳ��)
����������1������������ľ̿��Ũ���ᷴӦ����CO2��NO2��ˮ������A�й۲쵽���������к���ɫ�������ɡ���2��������������ˮ���������NO���������ǿ�����ԣ��������ͭ��Ӧ����B�з�Ӧ�����ӷ���ʽ��3NO2��H2O��2H����2NO3����NO����3Cu��8H����2NO3����3Cu2����2NO����4H2O����3����������������ˮ������װ��C�������Ƿ�ֹ��������Ӧ��NO������NO�Ǵ�����Ⱦ���װ��F������������δ��Ӧ��NO����4����ʯ�ҵ�����������NO�е�ˮ�����Ͷ�����̼�����߾���������Ʒ�Ӧ����������װ��D����E�в�������������⣬���и�������Na2CO3��NaOH��
�������ڶ�������Ҳ���������ԣ��������Ӧ����NO2�ܱ�Na2O2��ԭ��
��1��ʵ��ʱ����NO2����ͨ��ʢ��Na2O2�IJ������У�����ɫ��ĩ��ȫ��ɰ�ɫ��˵�������˻�ѧ��Ӧ����˼���һ����������2������������������������������Ϊ�����ƣ���Ӧ�Ļ�ѧ����ʽ��2NO2��Na2O2��2NaNO3����3��Ҫ��֤������Ƿ������ֻ��Ҫ�����Ƿ�����������Ƽ��ɣ�����������������ɣ�����������ȷ�����������Ϣ��֪���������ʹ���Ը��������Һ��ɫ������ʵ�������ȡ�����İ�ɫ���������Թ��У�������ˮ�ܽ⣬�ٵμ�ϡ�����ữ�����μӸ��������Һ��������������Һ����ɫ��������������������������Һ��ɫ����������������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫʹ�����ʴ���Һ���������ֲ��ı䵰���ʵ����ʣ�Ӧ������Լ��ǣ� ��
A.�Ҵ�
B.��������
C.����ǦŨ��Һ
D.��NH4��2SO4Ũ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ȷݡ�������һ��������ͭ�ۣ�������ܽ�19.2g (��֪����ֻ����ԭΪNO����)������һ�����������ۣ�������������������������ӵı仯����ͼ��ʾ�����з��������������
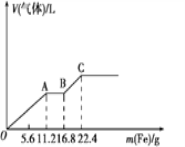
A. OA�β�������NO��AB�εķ�ӦΪFe+2Fe3+=3Fe2+��BC�β�������
B. ԭ�������SO42�����ʵ���Ϊ0.6 mol
C. �ڶ�����Һ����������ΪFeSO4
D. ȡ20mLԭ������ˮϡ����1L����Һ��c(H+)=0.2mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������л�ѧ����������ͬ����( )
A.HCl��MgCl2��NH4ClB.NH3��H2O��CO2
C.N2��Na2O��CS2D.CaCl2��NaOH��H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о�̼��������ᷴӦ�ķ�Ӧ���ʣ�ijͬѧͨ����ͼʵ��װ�òⶨ��Ӧ�����ɵ�CO2��������������Ƴ���ͼ��ʾ�����ߡ�����������������⡣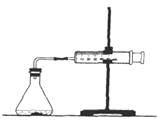
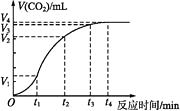
��1����ѧ��Ӧ��������ʱ����� �� Ӱ���ʱ��η�Ӧ���ʵ���Ҫ��������
A��O~t1 B��t1~t2 C��t2~t3 D��t3~t4
��2��Ϊ�˼���������Ӧ���ʣ����������м����������ʣ�����Ϊ���е�����
A.����ˮ
B.NaCl����
C.NaCl��Һ
D.ͨ��HCl
��3��������������20 mL��ͼ��CO2������DZ�״���µ��������t1~t2ʱ���ƽ����Ӧ����v(HCl)=mol��(L��min)-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH4HCO3���Թ��м��ȣ�ʹ�ų�����������ͨ��ʢ�������������Ƶĸ���ܡ�����Ũ�����ϴ��ƿ�����õ���������( )
A.NH3
B.H2O
C.O2
D.CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ϸ���Ļ��������������ȷ����
A�����ࡢ�̴��������ᡢ�����ᶼ���л���Ԫ�� C��H��O��N
B��ϸ�����������ӵĺ�����ά��ϸ�������ƽ������Ҫ����
C�������ʾ��е������ã����ȵ��غ�ø��
D��DNA�뵰���ʹ��ɵ�Ⱦɫ����ϸ�����е��Ŵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ե�10���ǻ�ϲ����Ľṹ��ͼ��ʾ�����й���10���ǻ�ϲ�����˵����ȷ���ǣ������� 
A.����ʽΪC20H16N2O5
B.������FeCl3��Һ������ɫ��Ӧ
C.���ܷ���������Ӧ
D.һ�������£�1mol������������1mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ��
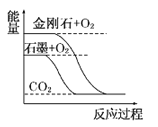
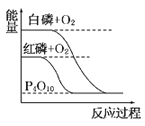
�ݴ��ж�����˵������ȷ����(����)
A. ʯīת��Ϊ���ʯ�����ȷ�Ӧ B. ���ױȺ����ȶ�
C. S(g)��O2(g)===SO2(g)����H1S(s)��O2(g)=SO2(g)����H2������H1>��H2 D. CO(g)��H2O(g)=CO2(g)��H2(g)����H>0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com