
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
根据上述数据:甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____________________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填“甲”或“乙”判断正确。试剂X是_____________(填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH_____(填“高于”、“低于”或“等于”)8.3,则_____(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(填“甲”或“乙”)判断是错误的,理由是_____________________________________________________。
【答案】 HCO3-+H2O![]() H2CO3+OH- 大于 乙 B 等于 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
H2CO3+OH- 大于 乙 B 等于 甲 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
【解析】试题分析:根据上述数据:甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为HCO3-+H2O![]() H2CO3+OH-。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
H2CO3+OH-。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
(1)只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生白色沉淀(碳酸钡),则乙判断正确。试剂X是BaCl2溶液。
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言甲和乙判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃。


科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
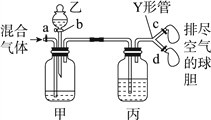
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 高温下,5.6 g Fe与足量水蒸气反应,转移的电子数为0.3NA
B. 标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
D. 向含有0.2 mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,所消耗OH-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T℃时AgCl的Ksp=2×10 -10,下列说法不正确的是( )
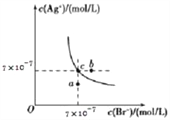
A. 在T℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr的饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是含AgBr的不饱和溶液
D. 在T℃时,AgCl(s)+Br -(aq)![]() AgBr(s)+Cl -(aq)的平衡常数K≈408
AgBr(s)+Cl -(aq)的平衡常数K≈408
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
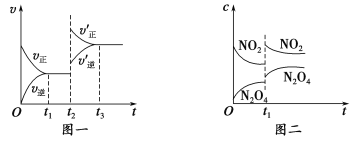
A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
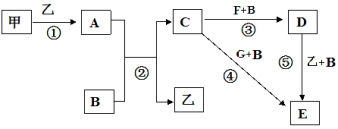
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com