
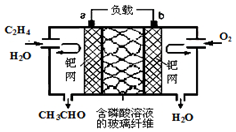
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
分析 由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答 解:A.充电时,不能生成乙烯和氧气,不能用作充电电池,所以不能实现电能转换成化学能,故A错误;
B.负极发生氧化反应,所以负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,故B正确;
C.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则向正极迁移H+0.4mol,故C错误;
D.电子只能经过导线,不能经过溶液,故D错误;
故选B.
点评 本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为D,注意电子不能流经溶液,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都约是22.4L | |
| B. | 1mol气态物质,当体积约为22.4L时,该气体一定处于标准状况下 | |
| C. | 在标准状况下,2mol酒精(CH3CH2OH)的体积为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | 含元素R的某种盐可作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述制氢气的反应式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$6nCO2↑+12nH2↑ | |
| B. | 从整个能量循环来看,利用该方法得到的氢能来源于光能 | |
| C. | 酶作为催化剂需要合适的温度 | |
| D. | 氢元素有3种核素,形成的H2分子有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素最高价氧化物水化物酸性越强,则对应元素非金属性越强 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
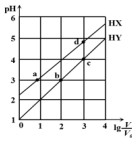 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
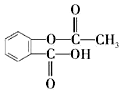
| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com