

| A、①③④ | B、②③④ |
| C、②③⑤ | D、①③ |
| 3.2g |
| 160g/mol |
| 0.48g |
| 16g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | SO2 | Ba(NO3)2 |
| ③ | NO2 | SO2 | BaCl2 |
| ④ | CO2 | NH3 | CaCl2 |
| A、②③④ | B、①②③ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、I-、CO32-、SO42- |
| B、Ca2+、H+、K+、HCO3- |
| C、Mg2+、Na+、SCN-、Cl- |
| D、Cu2+、Ba2+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| X(g) | Y(g) | Z(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
| Ⅲ | T | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.36 | B、6.72 |
| C、4.48 | D、8.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
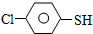 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.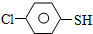 及X的核磁共振氢谱如图2,其中
及X的核磁共振氢谱如图2,其中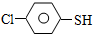 的核磁共振氢谱图.写出X的结构简式:
的核磁共振氢谱图.写出X的结构简式: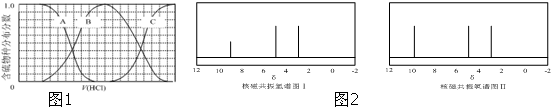
查看答案和解析>>
科目:高中化学 来源: 题型:
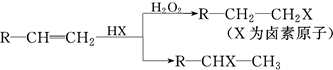
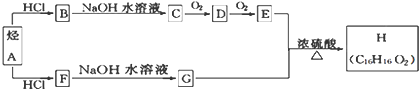
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的NaOH的物质的量相等 |
| B、若NaHA溶液的pH<7,则H2A一定是强酸 |
| C、将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(NH4+)=c(Cl一) |
| D、常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com