
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为
( )
A.9 B.10 C.11 D.12
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有机物A、B、C、D、E、F的转化关系如下:
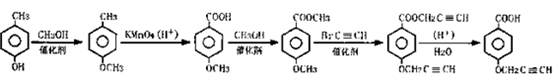
A B C D E F
(1)化合物D中含氧官能团有 、 (填名称)。
、 (填名称)。
(2)鉴别化合物E和F最适宜的试剂是 。化合物D到E的反应类型是 。
(3)化合物A最多有 个原子共平面。
(4)D的同分异构体很多,符合下列条件的同分异构体有____种。
①苯的衍生物且能使FeCl3溶液显紫色;②含有一个羧基;③分子中无甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 (保留小数点后四位)。
[实验二]探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
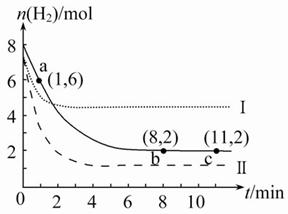 T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固定为2 L的密闭容器中,发生反应:aA(g)+bB(g) pC(g) ΔH=?反应情况记录如下表:
pC(g) ΔH=?反应情况记录如下表:
| 时间 | c(A)/mol·L-1 | c(B)/mol·L-1 | c(C)/mol·L-1 |
| 0 min | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
请仔细分析,根据表中数据,回答下列问题:
(1)第2 min到第4 min内A的平均反应速率v(A)=______mol·L-1·min-1。
(2)由表中数据可知反应在第4 min到第6 min时处于平衡状态,若在第2 min、第6 min、第8 min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2 min_________________或________________;
②第6 min_________________;
③第8 min_________________。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是将手持技术用于未知浓度盐酸滴定20.00 mL 0.1 mol·L-1NaOH溶液,测定盐酸浓度的实验(盐酸的滴定速率为0.098 mL·s-1)。下列有关说法中不正确的是( )
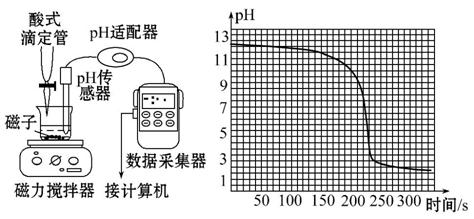
A.此中和滴定的反应原理是:H++OH-====H2O
B.H+与OH-反应生成水使溶液的pH发生变化,用传感器能精确测定出来
C.与传统中和滴定比较,可以避免酸碱指示剂对终点准确判断的难题
D.根据图中计算机绘制的酸碱中和滴定曲线可知:250 s时达到滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中正确的是( )
A.X位于元素周期表中第2周期ⅤA族
B.X元素有-3、+5两种化合价
C.X元素在元素周期表中的族序数肯定为奇数
D.X元素最高价氧化物对应的水化物可以表示为H3XO4
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料具有一些与传统材料不同的特征,具有广阔的应用前景。下列关于纳米材料基本构成微粒的叙述中,错误的是( )
A.三维空间尺寸必须都处于纳米尺寸
B.既不是微观粒子也不是宏观微粒
C.是原子排列成的纳米数量级原子团
D.是长程有序的晶状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
欲分离苯和苯酚,一般可向其混合物中加入稍过量的浓氢氧化钠溶液,反应的离子方程式为 。再将该混合物转移到分液漏斗中,振荡,静置后溶液将出现 现象,然后分液。从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是 ;向另一份溶液中加入浓溴水,发生反应的化学方程式是 。从分液漏斗上口倒出的上层液体是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com