
[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2• H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
某元素的一种同位素X的原子质量数为A,中子数为N,它与1H+组成XHm+离子,则ag XHm+中所含质子的物质的量是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
在250C某稀溶液中,由水电离产生的c(H+)=10-13mol/L,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH可能为1 D.该溶液的pH为7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________ (用离子方程式说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2 溶液中 c(NH4+)________(填“等于”、“大于”或“小于”) 0.1 mol·L-1 NH4HSO4溶液中 c(NH4+)。
(3)均为 0.1 mol·L-1 的几种电解质溶液的pH 随温度变化的曲线如图1所示。

①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填罗马数字),导致 NH4Al(SO4)2溶液的pH 随温度变化的原因是___________ 。
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中 2c(SO42-)-c(NH4+)-3c(Al3+)=___________mol·L-1。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加 0.1 mol/L的NaOH溶液,当加入NaOH溶液的体积分别为以下数据时:a、100ml b、150ml c、200ml。分析 a、b、c三种混合溶液中,水的电离程度最大的是______填(“a”、“b”或“c”);当加入NaOH溶液使溶液呈中性时,溶液中各离子浓度由大到小的排列顺序是_____ __ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:选择题
一定温度下,下列溶液的粒子关系式正确的是 ( )
A、PH=5的H2S溶液中,C(H+)=C(HS—)=1×10—5mol/L
B、PH=8的氨水溶液,稀释后,n(H+)与n(OH—)的乘积变大
C、PH=1的NaHSO4溶液中:C(H+)=2C(SO42—)+C(OH—)
D、PH=8的NaHCO3溶液中:c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三新考试大纲适应性考试化学卷(解析版) 题型:选择题
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。常温条件下反应时,溶液pH 随时间变化的曲线如图所示。下列判断错误的是
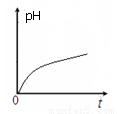
A.该反应的氧化剂是ClO-
B.该反应中有两种离子生成
C.该反应生成1mol氧化产物时,转移的电子为6 mol
D.参加反应的氧化剂与还原剂的物质的量之比为2 : 3
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第三次阶段测化学试卷(解析版) 题型:填空题
NO2 压缩成 N2O4 可作火箭燃料中的氧化剂,也可 制备硝化试剂 N2O5 等。
(1)火箭燃料燃烧反应如下:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l),若 1.00 g N2H4(l)与足量 N2O4(l)完全反应生成 N2(g)和 H2O(l),放出 19.14 kJ 的热量。则该反应的△H=___________kJ/mol。
(2)在 2 L 密闭容器内,投入一定量 NO2,发生下列反应: 2NO2(g)  2NO(g)+O2(g)。在三种不同的条件下进行实验,NO2 的浓度随时间的变化如图所示。请回答下列问题:
2NO(g)+O2(g)。在三种不同的条件下进行实验,NO2 的浓度随时间的变化如图所示。请回答下列问题:
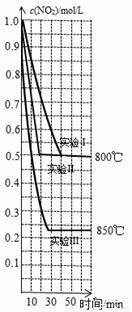
①不能说明该反应已达到平衡状态的是___________________(填字母)。
a.v 正(NO2)=2v 逆(O2)
b.c(NO2)= c(NO)
c.气体总压不变
d.NO 的体积分数保持不变
②下列说法正确的是___________________(填字母)。
a.三个实验开始投入的 NO2 的物质的量均为 1.0 mol
b.实验Ⅱ和实验Ⅰ相比,可能隐含的条件是:实验Ⅱ使用了效率更高的催化剂
c.该反应是放热反应
d.实验Ⅰ条件下反应的平衡常数大于实验Ⅲ条件下反应的平衡常数
e.800℃时,该反应的平衡常数为 0.25
f.该反应的△S>0,故该反应一定是自发反应
③实验Ⅱ从反应开始到刚达到平衡时,v(O2)=_________ mol/(L·min)
若再向该 2 L 密闭容器中通入 1 mol NO2、1 mol NO、0.5 mol O2,则平衡将 移动(填“向右”、“向左”或“不”)。
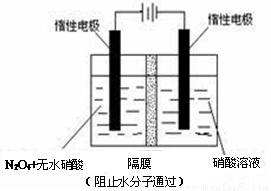
(3)利用 NO2 或 N2O4 可制备 N2O5,原理如上图所示。N2O5 在电解池的 ________(填“阴极”或“阳极”)区生成,其电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市钦州港区高三12月月考化学试卷(解析版) 题型:选择题
下图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反 应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-=CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:选择题
从葡萄籽中提取的原花青素结构为:
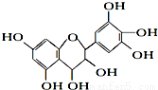
有关原花青素的下列说法不正确的( )
A.该物质既可看作醇类,也可看作酚类
B.1mol该物质可与4mol Br2反应
C.1mol该物质可与7mol Na反应
D.1mol该物质可与7mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com