
【题目】四川师范大学化学与材料学院对“铁与水蒸气反应”实验研究的结果显示:在80~100℃能产生稳定水蒸气的物质都可以作为该反应的供水剂;铁与水蒸气反应温度在500℃左右即可顺利进行。
某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是_______________。
(2)C中碱石灰的作用是______________。
(3)D处实验现象为___________________________。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

①加入稀硫酸发生的离子方程式为______________________________。
②试剂A是_____________(选填字母),现象2为___________________。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为_____(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是_______________________。
【答案】 3Fe + 4H2O![]() Fe3O4 + 4H2 干燥氢气 黑色固体变红 Fe3O4 + 8H+
Fe3O4 + 4H2 干燥氢气 黑色固体变红 Fe3O4 + 8H+ ![]() Fe2+ + 2Fe3+ + 4H2O b 溶液的紫色褪去 82.5% 产物是FeO和Fe2O3的混合物也能得到现象1和现象2
Fe2+ + 2Fe3+ + 4H2O b 溶液的紫色褪去 82.5% 产物是FeO和Fe2O3的混合物也能得到现象1和现象2
【解析】(1)A中铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe + 4H2O![]() Fe3O4 + 4H2;(2)C中碱石灰的作用是干燥氢气;(3)D处高温条件下氢气还原氧化铜生成铜单质,实验现象为黑色固体变红;(4)①加入稀硫酸后四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁和水,发生的离子方程式为:Fe3O4 + 8H+
Fe3O4 + 4H2;(2)C中碱石灰的作用是干燥氢气;(3)D处高温条件下氢气还原氧化铜生成铜单质,实验现象为黑色固体变红;(4)①加入稀硫酸后四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁和水,发生的离子方程式为:Fe3O4 + 8H+ ![]() Fe2+ + 2Fe3+ + 4H2O;②根据结论证明存在,说明加入试剂A为检验Fe2+的存在,Fe2+具有还原性,在有Fe3+存在的条件下选择进行检验;故试剂A为酸性KMnO4溶液,答案选b;KMnO4被还原Fe2+,现象2为溶液的紫色褪去;③根据反应3Fe + 4H2O
Fe2+ + 2Fe3+ + 4H2O;②根据结论证明存在,说明加入试剂A为检验Fe2+的存在,Fe2+具有还原性,在有Fe3+存在的条件下选择进行检验;故试剂A为酸性KMnO4溶液,答案选b;KMnO4被还原Fe2+,现象2为溶液的紫色褪去;③根据反应3Fe + 4H2O![]() Fe3O4 + 4H2可知,参加反应的铁粉的质量为:
Fe3O4 + 4H2可知,参加反应的铁粉的质量为: ![]() ,
, ![]() ;④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是产物是FeO和Fe2O3的混合物也能得到现象1和现象2。
;④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是产物是FeO和Fe2O3的混合物也能得到现象1和现象2。


科目:高中化学 来源: 题型:
【题目】根据热化学反应方程式:N2(g) + O2(g)→2NO(g)-180.58kJ,若在标准状况下反应生成11.2LNO,则此过程中共
A.放出45.145kJ的热量B.放出180.58kJ的热量
C.吸收45.145kJ的热量D.吸收90.29kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
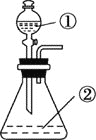
B. 用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
C. Al2O3和MgO均可与NaOH溶液反应
D. 在CO2中,Mg燃烧生成MgO和C在该反应条件下,Mg的还原性强于C的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和条件被略去,A、 X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;B、C、E是常见气体,G的焰色反应呈黄色;I的溶液呈黄色。

请回答下列问题:
(1)写出下列物质的化学式A___、F___;
(2)说出黄绿色气体C的一种用途___;
(3)实验室检验H中所含的金属阳离子的方法是,先加___无明显现象,再加氯水,溶液变为___色;
(4)写出C与H溶液反应的化学方程式___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是 (填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:取稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用硫酸将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4h后红纸褪色 |
已知,溶液中Cl2、HC1O和ClO-物质的量分数(α) 随pH变化的关系如下图所示:
①由实验现象可获得以下结论:溶液的pH在4 ~10范围内,pH越大,红纸褪色。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是。
(4)由于氯气会与自来水中的有机物发生反应,生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是将SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3。则每生成0.5 mol ClO2 , 转移mole-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com