
 ,反应类型为加聚反应.
,反应类型为加聚反应. 分析 (1)丙烯含有碳碳双键,可与溴水发生加成反应;
(2)马氏规则原理指:烯烃与氢加成,总是加在连氢最多的碳原子上,检查写出该反应的化学方程式;
(3)烷与氯气发生取代反应生成氯乙烷和HCl;
(4)有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,乙炔含有碳碳三键与氯化氢发生加成反应,然后发生加聚反应,据此写出反应的化学方程式并判断反应类型.
解答 解:(1)丙烯含有碳碳双键,可与溴水发生加成反应,反应的方程式为:CH3CH=CH2+Br2→CH3CHBr-CH2Br,
故答案为:CH3CH=CH2+Br2→CH3CHBr-CH2Br;
(2)根据马氏规则原理可知,丙烯与氯化氢发生加成反应为:CH2=CHCH3+HCl→CH3CHClCH3,
故答案为:CH2=CHCH3+HCl→CH3CHClCH3;
(3)乙烷与氯气发生取代反应生成氯乙烷和HCl,该反应为:C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl,
故答案为:C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl;取代;
(4)乙炔含有碳碳三键与氯化氢发生加成反应,CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl,
故答案为:CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl;加成;
(2)含有碳碳双键的有机物能发生加聚反应,氯乙烯发生加聚反应:nCH2=CHCl$\stackrel{催化剂}{→}$ ,
,
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$ ;加聚.
;加聚.
点评 本题考查了反应方程式的书写以及反应类型的判断,题目难度中等,把握有机物的结构与性质、有机反应类型为解答的关键,要求学生能够正确书写常见有机反应方程式.


科目:高中化学 来源: 题型:选择题
| A. | 向外供电时,锂离子向负极移动 | |
| B. | 负极上反应的物质是锂,正极上反应的物质是V2O5 | |
| C. | 正极的电极反应为:V2O5+xe-+xLi+═LixV2O5 | |
| D. | 负极的电极反应为:xLi-xe-═xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
| A. | X>0.05 | |
| B. | 将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大 | |
| C. | 实验①所得溶液c(A-)+c(HA)=0.10mol•L-1 | |
| D. | 实验②所得溶液:c(Na+)+c(OH-)=c(A-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 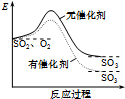 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 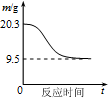 如图表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| C. | 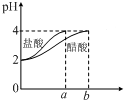 如图表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 | |
| D. | 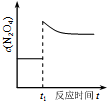 如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是10电子分子,具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | NH3•H2O是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
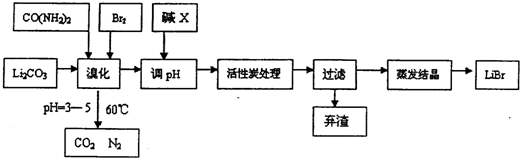
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com