
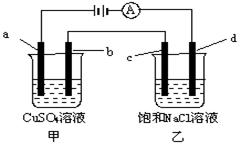
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a的电极反应式为:4OH――4e- = O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
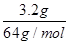 ×2=0.1mol,串联电路中转移电子相等,d极产生的气体体积=
×2=0.1mol,串联电路中转移电子相等,d极产生的气体体积=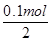 ×22.4L/mol=1.12L,故D错误,故答案选B。
×22.4L/mol=1.12L,故D错误,故答案选B。

科目:高中化学 来源:不详 题型:单选题
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
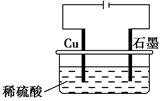
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
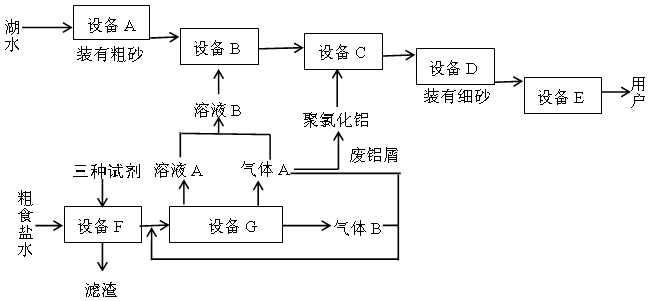

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极发生的反应只有:4OH--4e-=2H2O+O2↑ |
| B.两极得到的气体均为混合气体 |
| C.若Cu2+起始浓度为1 mol·L-1,则c(Cl-)起始为 2 mol·L-1 |
| D.Cu2+的起始物质的量应大于0.5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
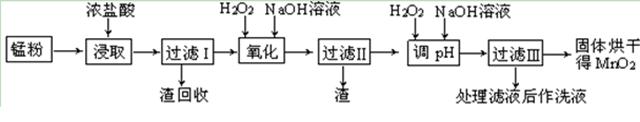
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
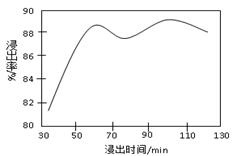
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
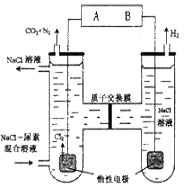
| A.B为 电 源 的正 极 |
| B.电解过程中,阳极室附近的PH保持不变 |
| C.电解过程中,电子由电源B端流出经溶液流回到电源A端 |
| D.右边发生的电极反应式为:2H2O +2e-= H2↑+ 2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
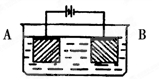
| A.4:1 | B.3:1 | C.2:1 | D.任意比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com