

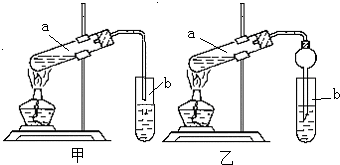
(1)写出甲试管中的主要化学反应方程式:_________________________________________。
(2)加入浓硫酸的目的是________________________________________________________。
(3)试管乙中观察到的现象是____________________________________________________。
(4)在实验中球形管除起冷凝作用外,另一个重要作用是_____________________,其原因是_____________________________________________________________________。
科目:高中化学 来源: 题型:阅读理解
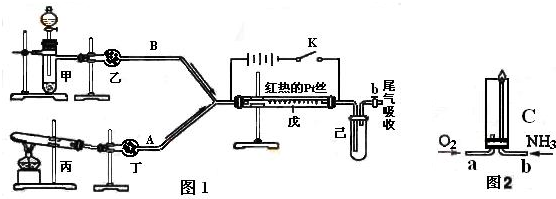
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:新疆自治区模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:

(1)写出甲试管中的主要化学反应方程式:_________________________________________。
(2)加入浓硫酸的目的是____________________________________________________。
(3)试管乙中观察到的现象是_________________________________________________。
(4)在实验中球形管除起冷凝作用外,另一个重要作用是____________________________,其原因是__________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com