
| A. | 正常雨水pH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
分析 A.正常的雨水因为溶解了少量的二氧化碳气体而显弱酸性,雨水的pH只是稍小于7,当雨水中溶解了二氧化硫、二氧化氮等物质时,雨水的酸性会明显增强,当达到一定程度时就形成酸雨,pH只是稍小于5.6;
B.Na的性质活泼,易与水反应、与空气中的氧气在点燃或加热时反应生成过氧化钠,过氧化钠能分别与水、二氧化碳反应;
C.根据铝的性质进行分析,铝在空气中易被氧气氧化生成致密的氧化物保护膜;
D.据化学反应遵循强酸制弱酸的原则,比较碳酸比硅酸强的反应在水溶液中进行,CO2通入可溶性硅酸盐中析出硅酸沉淀.
解答 解:A.正常雨水中因为溶有二氧化碳而显酸性,正常雨水的pH约为5.6,但酸雨的pH却小于5.6,故A错误;
B.金属钠着火时,与空气中的氧气反应生成过氧化钠,过氧化钠与水、二氧化碳反应,而干冰灭火器和泡沫灭火器都生成二氧化碳,只能用干燥沙土盖灭,故B错误;
C.通常情况下铝制品比铁更耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜从而阻止了内部的铝进一步氧化,所以铝比铁更容易被腐蚀,故C错误;
D.二氧化碳和水反应生成碳酸,碳酸和可溶性硅酸盐反应析出硅酸沉淀,说明碳酸能制取硅酸,所以能证明碳酸酸性强于硅酸酸性,故D正确;
故选D.
点评 本题主要考查了有关元素化合物的知识,注意物质的性质决定其用途,难度不大,注意A根据化学反应遵循强酸制弱酸的原则,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
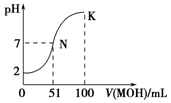 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
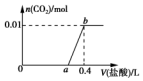 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 氧化性强弱的比较:KClO3<Cl2 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量全部是由化学反应产生的 | |
| B. | 化学反应不一定伴随着能量变化 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物质量的多少无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com