
����Ŀ��Ԫ��A��B��D��E��F��G��Ϊ����������Ԫ�أ���ԭ��������������ֻ��EΪ����Ԫ�ء���֪Aԭ��ֻ��һ�����Ӳ㣻E��F��ԭ�������ֱ���B��D��2��������D��Fͬ���壬B��E��ͬ���塣�ش��������⣺
��1��Ԫ��D�����ڱ��е�λ��____��
��2��F��G�γɵĻ��������������ԭ�Ӿ�Ϊ8�����ȶ��ṹ���û�����ĵ���ʽΪ____��
��3��������Ԫ����ɵ������У�������Ҫ��д����ѧ����ʽ
���������ᷴӦ��������ǿ��______��
���û���Ӧ�����������ڳ��¾�Ϊ��̬____��
��4����D��F��G��ѡȡ2��Ԫ����ɾ���Ư�ס�ɱ�����õĻ�����___��
���𰸡��ڶ�����VI A�� ![]() ��
��![]()
![]()
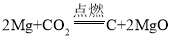 ClO2��SO2
ClO2��SO2
��������
AԪ��Ϊ����������Ԫ�أ���Aԭ��ֻ��һ�����Ӳ㣬����AΪ��Ԫ�أ�F��ԭ��������D��2������D��F��ͬһ���壬����DΪ��Ԫ�أ�FΪ��Ԫ�أ���GΪ��Ԫ�أ�EΪ����Ԫ�أ���ԭ��������B��2��������E���������Ϊż����λ�ڵ������ڣ�ΪþԪ�أ�����B��̼Ԫ�ء���A��B��D��E��F��G������H��C��O��Mg��S��ClԪ�ء�
(1)Ԫ��DΪ��Ԫ�أ�λ�ڵڶ�����VI A�壻
(2)FΪ��Ԫ�أ�GΪ��Ԫ�أ��γɵĻ��������������ԭ�Ӿ�����8�����ȶ��ṹ������Ӧ��2�ۣ�����1�ۣ����Ըû�����ΪSCl2��S2Cl2��������ͬ���壬Ҳ�����γ�����Ǽ��Թ��ۼ��������Ӧ�ĵ���ʽΪ![]() ��
��
(3)��������ǿ�ᣬͨ����������������ԭ��Ӧ������������Ԫ���У�����ǿ�����Ե������뵽�����ᣬ���ֻ�ԭ�Ե����뵽H2S��H2SO3�ȣ���������ֻ��H2SO3������ᷴӦ���ɵ�������ǿ�H2SO3+HClO=HCl+H2SO4��
���û���Ӧ��Ҫ�е��ʲ��룬�������Ϊ���壬�ų����ȡ���ȣ��뵽þ�Ͷ�����̼��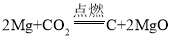 ��
��
(4)��ѧѧϰ�ľ���Ư���Ե����ʰ����������������ơ��������⡢�����ᡢ�������ȵȣ�������������Ԫ����ɵ������Ԫ��Ϊ2�ֵģ��뵽�˶������ȡ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������SO2��ԭMnO2�Ʊ�MnSO4��װ����ͼ��ʾ������˵����ȷ����( )
A.װ��B���Լ���ΪNa2SO3��Һ���������dz�ȥSO2�е�HCl
B.װ��D��ˮԡ�¶�Ӧ������80�����ң��¶ȹ���ʱ��Ӧ���ʿ��ܼ���
C.��װ��D������MnSO4��Һ���ɿɻ�ô�����MnSO4��H2O
D.װ��E�з�����Ӧ�����ӷ���ʽΪSO2+2OH����SO32-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2020��2�£���ѧ�ұ��������ô�������Fe3O4������ȥˮ��ݸ����Ⱦ��ķ�������ԭ������ͼ��ʾ����Fe3O4������ˮ�б�����-OH����ˮ��pH��4ʱ����Ч����ã�������˵������ȷ����

A.�ݸ�좼ȿ��Ժ����ᷴӦ���ֿ��Ժ�����������Һ��Ӧ
B.Fe3O4��������ȥ�ݸ�좵Ĺ����л�ѧ�����γɺͶ���
C.Fe3O4����������ԽС��ˮ��pHԽ�����Ч��Խ��
D.������ɺ�Fe3O4�����������ô������գ������Ȼ�ظ�ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3�Ļ�������ɿˣ�������H2�����м��ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������0.8g������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ�, ������Ҫ1molL��1����������Ϊ�� ��
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֵ���ɫ���壬�����������̼��Ӧ������������DZˮͧ�����������������������֮�ã����������̼��Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2=2Na2CO3+O2��ijѧ��Ϊ����֤��һʵ�飬�������Ĵ���ʯ�������������1.95�˹���������ƷΪԭ�ϣ���ȡO2����Ƴ�����ʵ��װ�ã�
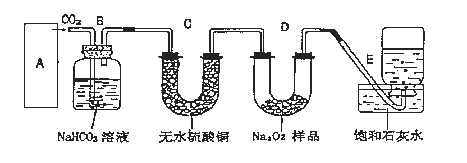
��1��A����ȡCO2 ��װ�ã�Ӧ������ͼ������������ѡ�ĸ�ͼ��___��
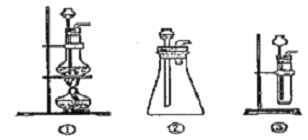
Bװ�õ�������___��Cװ���ڿ��ܳ��ֵ�������___��Ϊ�˼���E���ռ��������壬��ȡ������ƿ���鷽����___��
��2����E�е�ʯ��ˮ���ֳ�������ɫ���ǣ���˵��ԭ��___���������ӷ�Ӧ����ʽ��ʾ����
��3����Ӧ���ʱ�������E�еļ���ƿ�ռ���������Ϊ260mL����װ�õ����������õ�����£�ʵ���ռ�����������������ۼ���ֵ___������С�������___mL��ȡ����ֵ���������ݾ��ڱ�״���²ⶨ������������____��
��4������Ϊ����A-E��ʵ��װ���У�E�����Ƿ�ȫ��������___�����ǻ��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����͵��Ļ������ڹ�ũҵ�����������������ж��м���㷺����;����ش������뵪Ԫ���йص����⣺
��1���������ȣ��ṹʽΪCl-N=O�����л��ϳ��е���Ҫ�Լ�������Cl2��NO��ͨ�������·�Ӧ�Ƶã���Ӧ����ʽΪ![]() ��
��
��֪���ֻ�ѧ���ļ������������ʾ��
��ѧ�� |
|
|
|
|
���ܣ� | 243 | a | 607 | 630 |
��Cl2��NO��Ӧ����ClNO�Ĺ�����ת����4mol���ӣ������Ϸų�������Ϊ___kJ���������ֺ���ĸ��ʾ��
��2���¶�һ��ʱ����һ�����Ϊ1L���ܱ�������ͨ��2mol NO��1mol Cl2��10minʱClNO���ռ���������40%����Ӧ��ʼ��10min��NO��ƽ����Ӧ���ʣ�![]() =___
=___![]() ��
��
��3�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ�װ����ͼ��ʾ��
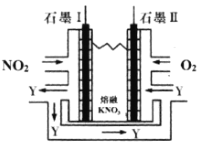
��ع���ʱ��NO2ת�����ɫ������Y��N2O5������ѭ��ʹ�ã���ʯī��Ϊ��Դ____����ʯī�����������ĵ缫��ӦʽΪ___��
��4��������ˮ����ˮ�����ɸ�Ӫ��������ʹ�ô�����ȥ����������NH4+��ʾ���������������ʡ�������������ȥ���������ӷ�Ӧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ���ң�����ܷ�ӦΪ��2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����

A. ʯī�缫�ϲ�������
B. ͭ�缫������ԭ��Ӧ
C. ͭ�缫��ֱ����Դ�ĸ���
D. ����0.1 mol����ת��ʱ����0.1 mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ�����˹���Ҷ���ĵ绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ��(C3H8O)������˵���������
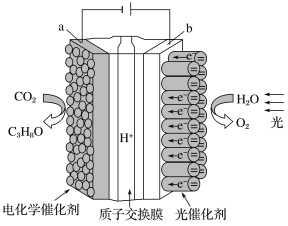
A. ��װ�ù���ʱ��H����b������a����Ǩ��
B. a�缫�ķ�ӦΪ��3CO2+18H��+18e��=C3H8O+5H2O
C. ÿ����1 mol O2����44 g CO2����ԭ
D. C3H8O�γ�ȼ�ϵ��������������Һ��Ϊ�������Һ�ĸ�����Ӧʽ��C3H8O��18e��+24OH��=3CO32-+16H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18g̼�������״����22.4LO2��Ӧ�ų�������Q1kJ����֪��̼��������1molCO2�������Q2kJ������˵������ȷ���ǣ� ��
A. ��̼ȼ������CO���Ȼ�ѧ����ʽ��C(s)+1/2O2(g)=CO(g) ��H=(Q1-0.5Q2)kJ/mol
B. ��̼ȼ������1molCO�ų���������(Q1-0.5Q2)kJ
C. ��̼ȼ������CO���Ȼ�ѧ����ʽ��2C(s)+O2(g)=2CO(g) ��H=(Q2-2Q1)kJ/mol
D. ̼��CO2��Ӧ���Ȼ�ѧ����ʽ��C(s)+CO2(g)=2CO(g) ��H=(2Q2-2Q1)kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com