
| A. | Kw(NH3•H2O) | B. | n(OH-) | C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | D. | c(H+) |
分析 将浓度为0.1mol/L的氨水加水不断稀释,一水合氨的电离程度逐渐增大,则溶液中铵根离子、氢氧根离子的物质的量增大,一水合氨的物质的量减小,同一溶液中,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$的比值逐渐减小;温度不变,一水合氨的电离平衡常数、水的离子积不变,由于稀释过程中氢氧根离子浓度减小,则氢离子浓度增大,据此进行判断.
解答 解:A.稀释过程中温度不变,则一水合氨的电离平衡常数不变,故A错误;
B.稀释过程中一水合氨的电离程度增大,则溶液中氢氧根离子的物质的量增大,故B错误;
C.稀释过程中氢氧根离子的物质的量增大,一水合氨的物质的量减小,同一溶液中,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$的比值逐渐减小,故C正确;
D.稀释过程中氢氧根离子浓度减小,水的离子积不变,则氢离子浓度增大,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响电离平衡的因素为解答关键,注意稀释过程中水的离子积不变,而氢氧根离子浓度减小,则氢离子浓度增大,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.| A. | 加强海底可燃冰的探测与开发研究 | |
| B. | 积极推广风能、水能和太阳能发电 | |
| C. | 在生产、流通、消费等领域中实行“减量化、再利用、资源化” | |
| D. | 将高能耗、高污染的企业迁至偏僻的农村地区,提高农民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
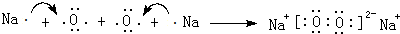 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
| 空 | 空 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
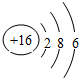 .
.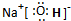 ,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.
,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2═2H2O+O2↑ | B. | HCl+NaOH═H2O+NaCl | ||
| C. | Fe+CuCl2═FeCl2+Cu | D. | 2Cu+O2═2CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
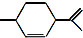 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 常温下呈液态,难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{{c({C{H_3}CO{O^-}})}}{{c({C{H_3}COOH})}}$的值增大到原来的10倍 | |
| C. | pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①>③>② | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com