
| A、常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B、15g C2H6含C-H键数目为3NA |
| C、28g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D、7.8g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
| m |
| M |
| m |
| M |
| m |
| M |
| m |
| M |
| 30g |
| 60g/mol |
| m |
| M |
| 15g |
| 30g/mol |
| 28g |
| 14g/mol |


科目:高中化学 来源: 题型:
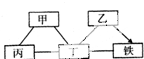 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“一”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系).下列判断合理的是( )
现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“一”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系).下列判断合理的是( )| A、丙可能是碳酸钠溶液 |
| B、丁可能是氢氧化钙溶液 |
| C、乙必须通过置换反应转化为铁 |
| D、甲和丁的反应一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液仍为紫色 |
| B、最后溶液变为蓝色且有气泡产生 |
| C、最后溶液退色 |
| D、振荡后向其中加入FeCl2溶液一定不会出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com