
| A、46.5% |
| B、23.3% |
| C、21.7% |
| D、35.7% |
| 2×(28+32) |
| 102+120+36 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 盐MN溶于水的过程如图所示:下列说法不正确的是( )
盐MN溶于水的过程如图所示:下列说法不正确的是( )| A、MN是强电解质 |
| B、N-结合H+的能力一定比OH-强 |
| C、该过程中c(OH-)>c(H+) |
| D、溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、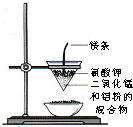 用如图装置制取少量金属锰 |
D、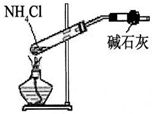 实验室用如图所示装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D、金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )
FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )| A、△H>O |
| B、反应处于D点时,一定有v正<v逆 |
| C、溶液中c(Fe3+):A点>B点 |
| D、T1、T2时相应的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③④ |
| C、①③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com