
| A£® | 1molCnH2n-2£Øn”Ż2£©ÖŠĖłŗ¬µÄ¹²ÓƵē×Ó¶ŌŹżĪŖ£Ø3n+l£©NA | |
| B£® | ŌŚK37ClO3+6H35Cl£ØÅØ£©ØTKCl+3Cl2”ü+3H2O·“Ó¦ÖŠ£¬ČōÓŠ212æĖĀČĘųÉś³É£¬Ōņ·“Ó¦ÖŠµē×Ó ×ŖŅʵďżÄæĪŖ5NA | |
| C£® | 60 æĖµÄŅŅĖįŗĶĘĻĢŃĢĒ»ģŗĻĪļ³ä·ÖČ¼ÉÕĻūŗÄ2NAøöO2 | |
| D£® | 5.8 gŹģŹÆøą£Ø2CaSO4•H2O£©ŗ¬ÓŠµÄ½į¾§Ė®·Ö×ÓŹżĪŖ0.02NA |
·ÖĪö A£®CnH2n-2ÖŠCŌ×ÓÓėHŌ×ÓÖ®¼äµÄ¹²ÓƵē×Ó¶ŌŹżĪŖ£Ø2n-2£©£¬¶ųCŌ×ÓÖ®¼äµÄ¹²ÓƵē×Ó¶ŌŹżĪŖn-1+2=n+1£»
B£®øĆ·“Ó¦ÖŠClŌŖĖŲ»ÆŗĻ¼ŪÓÉ+5¼Ū”¢-1¼Ū±äĪŖ0¼Ū£¬ÓŠ$\frac{1}{6}$µÄHCl²»×÷»¹Ō¼Į£¬ĘšĖįµÄ×÷ÓĆ£¬Ńõ»Æ¼ĮŹĒK37ClO3”¢»¹Ō¼Į H35Cl£¬øĆ·“Ó¦×ŖŅʵĵē×ÓŹżĪŖ5e-£®£»
C£®ŅŅĖįÓėĘĻĢŃĢĒ×ī¼ņŹ½¶¼ŹĒCH2O£»
D£®ÖŹĮæ×Ŗ»ÆĪŖĪļÖŹµÄĮ棬½įŗĻ1øö2CaSO4•H2Oŗ¬ÓŠ2øöĖ®·Ö×Ó£®
½ā“š ½ā£ŗA£®CnH2n-2ÖŠCŌ×ÓÓėHŌ×ÓÖ®¼äµÄ¹²ÓƵē×Ó¶ŌĪŖ£Ø2n-2£©¶Ō£¬¶ųCŌ×ÓÖ®¼äµÄ¹²ÓƵē×Ó¶ŌĪŖn-1+2=n+1¶Ō£¬¼“CnH2n-2ÖŠŗ¬¹²ÓƵē×Ó¶ŌĪŖ£Ø2n-2£©+£Øn+1£©=£Ø3n-1£©¶Ō£¬¹Ź1 mol CnH2n-2£Øn”Ż2£©ÖŠĖłŗ¬µÄ¹²ÓƵē×Ó¶ŌŹżĪŖ£Ø3n-1£©NA£¬¹ŹA“ķĪó£»
B£®Éś³ÉµÄ3molĀČĘųÖŠŗ¬6molCl£¬ĘäÖŠ1molĪŖ 37Cl£¬5molĪŖ35Cl£¬Éś³ÉĀČĘųĦ¶ūÖŹĮæ=$\frac{1”Į37+5”Į35}{70.7}$=70.7g/mol£¬ČōÓŠ212æĖĀČĘųÉś³ÉĪļÖŹµÄĮæ=$\frac{212g}{70.7g/mol}$=3mol£¬Éś³É3molĀČĘųµē×Ó×ŖŅĘ5mol£¬¹ŹBÕżČ·£»
C£®ŅŅĖįÓėĘĻĢŃĢĒ×ī¼ņŹ½¶¼ŹĒCH2O£¬1øöCH2OĶźČ«Č¼ÉÕĻūŗÄ1øöŃõĘų·Ö×Ó£¬60æĖµÄŅŅĖįŗĶĘĻĢŃĢĒ»ģŗĻĪļŗ¬ÓŠCH2OĪļÖŹĮæĪŖ2mol£¬³ä·ÖČ¼ÉÕĻūŗÄ2NAøöO2£¬¹ŹCÕżČ·£»
D£®ŹģŹÆøą£Ø2CaSO4•H2O£©µÄĪļÖŹµÄĮæn=$\frac{m}{M}$=$\frac{5.8g}{290g/mol}$=0.02mol£¬ÓÉŹģŹÆøą£Ø2CaSO4•H2O£©µÄ»ÆѧŹ½æÉÖŖ£¬1molŹģŹÆøą£Ø2CaSO4•H2O£©ÖŠŗ¬1molĖ®£¬¹Ź0.02molĖ®ÖŠŗ¬0.02molĖ®£¬¼“0.02NAøö£¬¹ŹDÕżČ·£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģā漲鰢·ü¼ÓµĀĀŽ³£ŹżµÄ×ŪŗĻÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·ŅŌĪļÖŹµÄĮæĪŖÖŠŠÄµÄø÷»ÆѧĮæÓė°¢·ü¼ÓµĀĀŽ³£ŹżµÄ¹ŲĻµĪŖ½ā“š¹Ų¼ü£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪöÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø
ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ijĶ¬Ń§°“ČēĶ¼ĖłŹ¾µÄ×°ÖĆ×öŹµŃ飬²¢¼ĒĀ¼ŹµŃéĒéæö£®ÄćČĻĪŖæņÄŚŠšŹöŗĻĄķµÄŹĒ£Ø””””£©””
ijĶ¬Ń§°“ČēĶ¼ĖłŹ¾µÄ×°ÖĆ×öŹµŃ飬²¢¼ĒĀ¼ŹµŃéĒéæö£®ÄćČĻĪŖæņÄŚŠšŹöŗĻĄķµÄŹĒ£Ø””””£©””| A£® | ¢Ł¢Ś¢Ū | B£® | ¢Ū¢Ü¢Ż | C£® | ¢Ū¢Ü¢Ž | D£® | ¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ½«ø÷1molµÄČżÖÖĪļÖŹ·Ö±šÓėĒāŃõ»ÆÄĘČÜŅŗ³ä·Ö·“Ó¦£¬°¢Ė¾Ę„ĮÖĻūŗÄĒāŃõ»ÆÄĘ×ī¶ą | |
| B£® | ČżÖÖÓŠ»śĪļ±½»·ÉĻµÄĒāŌ×ÓČō±»ĀČŌ×ÓČ”“ś£¬ĘäŅ»ĀČ“śĪļ¶¼Ö»ÓŠ2ÖÖ | |
| C£® | ČżÖÖÓŠ»śĪļÖŠµÄĖłÓŠŌ×Ó²»æÉÄܹ²Ę½Ćę | |
| D£® | ČżÖÖÓŠ»śĪļ¶¼ÄÜÓėÅØäåĖ®·¢Éś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĮņĖįŹĒŅ»ÖÖÖŲŅŖµÄ»ł±¾»Æ¹¤ŌĮĻ£¬ĪŅ¹śµÄĮņ»Ē׏Ō“Ļą¶Ō¶Ģȱ£¬Ö÷ŅŖÓĆ»ĘĢśæó£ØFeS2£¬ĘäÖŠSĪŖ-1¼Ū£©Éś²śĮņĖįµÄÖŲŅŖŌĮĻ£¬Éś²ś¹ż³ĢÖŠÖ÷ŅŖÓŠČżøö²½Öč£ŗ
ĮņĖįŹĒŅ»ÖÖÖŲŅŖµÄ»ł±¾»Æ¹¤ŌĮĻ£¬ĪŅ¹śµÄĮņ»Ē׏Ō“Ļą¶Ō¶Ģȱ£¬Ö÷ŅŖÓĆ»ĘĢśæó£ØFeS2£¬ĘäÖŠSĪŖ-1¼Ū£©Éś²śĮņĖįµÄÖŲŅŖŌĮĻ£¬Éś²ś¹ż³ĢÖŠÖ÷ŅŖÓŠČżøö²½Öč£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ½šŹō£ØM£©-æÕĘųµē³Ų£ØČēĶ¼£©¾ßÓŠŌĮĻŅ×µĆ£¬ÄÜĮæĆܶČøßµČÓÅµć£¬ÓŠĶū³ÉĪŖŠĀÄÜŌ“Ęū³µŗĶŅʶÆÉč±øµÄµēŌ“£¬øĆĄąµē³Ų·ÅµēµÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗ4M+nO2+2nH2OØT4M£ØOH£©n£¬¼ŗÖŖ£ŗµē³ŲµÄ”°ĄķĀŪ±ČÄÜĮæ”±Öøµ„Ī»ÖŹĮæµÄµē¼«²ÄĮĻĄķĀŪÉĻÄÜŹĶ·Å³öµÄ×ī“óµēÄÜ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
½šŹō£ØM£©-æÕĘųµē³Ų£ØČēĶ¼£©¾ßÓŠŌĮĻŅ×µĆ£¬ÄÜĮæĆܶČøßµČÓÅµć£¬ÓŠĶū³ÉĪŖŠĀÄÜŌ“Ęū³µŗĶŅʶÆÉč±øµÄµēŌ“£¬øĆĄąµē³Ų·ÅµēµÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗ4M+nO2+2nH2OØT4M£ØOH£©n£¬¼ŗÖŖ£ŗµē³ŲµÄ”°ĄķĀŪ±ČÄÜĮæ”±Öøµ„Ī»ÖŹĮæµÄµē¼«²ÄĮĻĄķĀŪÉĻÄÜŹĶ·Å³öµÄ×ī“óµēÄÜ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ²ÉÓƶąæ×µē¼«µÄÄæµÄŹĒĢįøßµē¼«Óėµē½āÖŹČÜŅŗµÄ½Ó“„Ć껿£¬²¢ÓŠĄūÓŚŃõĘųĄ©É¢ÖĮµē¼«±ķĆę | |
| B£® | ŌŚMg-æÕĘųµē³ŲÖŠ£¬ĪŖ·ĄÖ¹øŗ¼«Ēų³Į»żMg£ØOH£©2£¬ŅĖ²ÉÓĆÖŠŠŌµē½āÖŹ¼°ŃōĄė×Ó½»»»Ä¤ | |
| C£® | M-æÕĘųµē³Ų·Åµē¹ż³ĢµÄÕż¼«·“Ó¦Ź½£ŗÕż¼«·“Ó¦Ź½ĪŖO2+2H2O+4e-ØT4OH- | |
| D£® | ±Č½ĻMg”¢Al”¢ZnČżÖÖ½šŹō-æÕĘųµē³Ų£¬Mg-æÕĘųµē³ŲµÄĄķĀŪ±ČÄÜĮæ×īøß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °“ĻµĶ³ĆüĆū·Ø£¬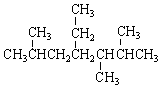 µÄĆū³ĘĪŖ2£¬5£¬6-Čż¼×»ł-4-ŅŅ»łøżĶé µÄĆū³ĘĪŖ2£¬5£¬6-Čż¼×»ł-4-ŅŅ»łøżĶé | |
| B£® | ³£Ń¹ĻĀ£¬ÕżĪģĶ锢ŅģĪģĶ锢ŠĀĪģĶéµÄ·ŠµćŅĄ“ĪŌö“ó | |
| C£® | ¼”“¼ 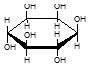 ÓėĘĻĢŃĢĒ ÓėĘĻĢŃĢĒ 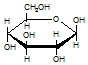 µÄŌŖĖŲ×é³ÉĻąĶ¬£¬»ÆѧŹ½¾łĪŖC6H12O6£¬Āś×ćCm£ØH2O£©n£¬Ņņ“Ė£¬¾łŹōÓŚĢĒĄą»ÆŗĻĪļ µÄŌŖĖŲ×é³ÉĻąĶ¬£¬»ÆѧŹ½¾łĪŖC6H12O6£¬Āś×ćCm£ØH2O£©n£¬Ņņ“Ė£¬¾łŹōÓŚĢĒĄą»ÆŗĻĪļ | |
| D£® | 1.0 molµÄ 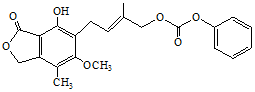 ×ī¶ąÄÜÓėŗ¬5.0 mol NaOHµÄĖ®ČÜŅŗĶźČ«·“Ó¦ ×ī¶ąÄÜÓėŗ¬5.0 mol NaOHµÄĖ®ČÜŅŗĶźČ«·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃé | ĻÖĻó | ½įĀŪ |
| Ļņµķ·ŪĖ®½āŗóµÄČÜŅŗÖŠ¼ÓČėµāĖ® | ČÜŅŗ±äĄ¶É« | µķ·ŪƻӊĖ®½ā | |
| ½«±½µĪČėäåĖ®ÖŠ£¬Õńµ“£¬¾²ÖĆ | äåĖ®²ćĶŹÉ« | äåŗĶ±½·¢Éś¼Ó³É·“Ó¦ | |
| Ļņ1.0mol•L-1µÄNaHCO3ČÜŅŗÖŠµĪ¼Ó2µĪ¼×»ł³Č | ČÜŅŗ³Ź»ĘÉ« | NaHCO3ČÜŅŗ³Ź¼īŠŌ | |
| ĻąĶ¬µÄĀĮʬ·Ö±šÓėĶ¬ĪĀĶ¬Ģå»ż£¬ĒŅc£ØH+£©=1mol•L-1µÄŃĪĖį”¢ĮņĖį·“Ó¦ | ĀĮÓėŃĪĖį·“Ó¦²śÉśĘųÅŻ½Ļæģ | æÉÄÜŹĒCl-¶ŌøĆ·“Ӧʚµ½“Ł½ų×÷ÓĆ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2 mol NaOHµÄĦ¶ūÖŹĮæĪŖ80g/mol | |
| B£® | S2ŗĶS8µÄ»ģŗĻĪļ¹²6.4 g£¬ĘäÖŠĖłŗ¬ĮņŌ×ÓŹżŅ»¶ØĪŖ0.2 NA | |
| C£® | 1molNa2O2Óė×ćĮæCO2·“Ó¦×ŖŅʵĵē×ÓŹżĪŖ2NAøö | |
| D£® | 0.1molKHSO4¾§ĢåÖŠŃōĄė×Ó×ÜŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĶÖ¬”¢µķ·ŪŗĶµ°°×ÖŹ¶¼ŹĒøß·Ö×Ó»ÆŗĻĪļ£¬ĖüĆĒŌŚŅ»¶ØĢõ¼žĻĀ¶¼ÄÜĖ®½ā | |
| B£® | ÓĆ 95%µÄŅ½Ņ©¾Ę¾«Ļū¶¾ | |
| C£® | ŅŅĻ©”¢¾ŪŅŅĻ©¾łæÉŹ¹äåĖ®·“Ó¦ĶŹÉ« | |
| D£® | ŹÆÓĶµÄĮŃ»Æ”¢ĮŃ½ā”¢ĆŗµÄøÉĮó¶¼ŹōÓŚ»Æѧ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com