
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO ![]() 、NO
、NO ![]() 、CO
、CO ![]()
B.由水电离产生的c(H+)=10﹣12mol?L﹣1的溶液:NH4+、SO ![]() 、HCO
、HCO ![]() 、Cl﹣
、Cl﹣
C.含有0.1 mol?L﹣1 HCO3﹣的溶液:Na+、Fe3+、NO ![]() 、SCN﹣
、SCN﹣
D.![]() =0.1 mol?L﹣1的溶液:Na+、K+、CO
=0.1 mol?L﹣1的溶液:Na+、K+、CO ![]() 、NO
、NO ![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图像与对应的叙述相符的是
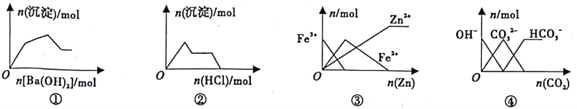
A. 图①表示向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
B. 图②表示向NaAlO2溶波中逐滴加入盐酸
C. 图③表示向FeCl3溶液中加入锌粉
D. 图④表示向NaOH溶液通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去.已知室温下Ksp(FeS)=6.3×10﹣18mol2L﹣2 , Ksp(CuS)=1.3×10﹣36mol2L﹣2 . ①请用离子方程式说明上述除杂的原理 .
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
A.Ba(NO3)2B.BaCl2
C.Ba(OH)2D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 .
(2)电解法处理酸性含铬废水(主要含有Cr2O72﹣)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是(填序号)
A.阳极反应为Fe﹣2e﹣═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72﹣被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池.图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是________________________________________。
(4)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式____________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为______(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向
B. 光合作用是将光能转化为化学能的有效途径
C. 石油、煤、天然气属于二次能源
D. 绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与水的反应可表示为:3NO2+H2O=2HNO3+NO,关于此反应中的下列说法正确的是( )
A.氮元素的化合价没有发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂,又是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com