
| A. | 铝投入盐酸中 | B. | 液态水变成水蒸气 | ||
| C. | 煅烧石灰石生成生石灰和二氧化碳 | D. | 氧分子变成氧原子 |
科目:高中化学 来源: 题型:填空题
 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2通入石灰水中 | B. | CO2通入过氧化钠中 | ||
| C. | NO2通入水中 | D. | SO2通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②③⑦ | C. | ①⑥ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试管1:滴加3滴浓硫酸 | 试管2:滴加3滴NaOH溶液 | |
| 实验现象 | ||
| 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
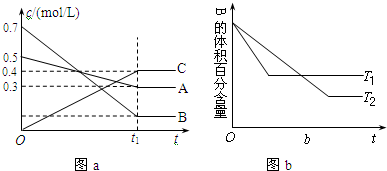
| A. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| B. | T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC反应,达到平衡后,C的浓度仍为0.4mol/L | |
| C. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| D. | (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com