
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:
CH4( g) +CO2( g) ![]() 2CO( g)+2H2( g) △H1=+247kJ·mol-1
2CO( g)+2H2( g) △H1=+247kJ·mol-1
CH4(g) +H2O(g) ![]() CO( g)+3H2(g) △H2=+205kJ mol-1
CO( g)+3H2(g) △H2=+205kJ mol-1
写出CO2重整的热化学方程式_________________。
(2)“亚硫酸盐法”吸收烟气中的SO2。
①将烟气通入1.0mol·L-1的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___________。(填“减小”、“ 不变”或 “增大”)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol ·L-1,则溶液中c(HSO3-)=____________。
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图甲所示。

a点时n(HSO3-):n(H2SO3)=__________,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___________。
(3)催化氧化法去除NO,—定条知下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分別为4:1、3:3、1:3时,得到NO脱除率曲线如图乙所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分別为4:1、3:3、1:3时,得到NO脱除率曲线如图乙所示:
①曲线a中NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率
为__________mg/(m3·s)
②曲线b对应NH3与NO的物质的量之比是__________。
(4)间接电化学法除NO。其原理如图丙所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):________________;吸收池中除去NO的原理:________________ (用离子方程式表示)。
【答案】 CO2 (g) +4H2(g) ![]() CH4 (g) +2H2O (g) ΔH= - 163kJ/mol 减小 1.6mol/L 1:1 3: 1 1.5×10-4 3:1 2HSO3-+2e-+2H+ ═S2O42-+2H2O 2NO + 2S2O42-+2H2O═N2 + 4HSO3-
CH4 (g) +2H2O (g) ΔH= - 163kJ/mol 减小 1.6mol/L 1:1 3: 1 1.5×10-4 3:1 2HSO3-+2e-+2H+ ═S2O42-+2H2O 2NO + 2S2O42-+2H2O═N2 + 4HSO3-
【解析】(1)用CO2和H2为原料可得到CH4燃料的反应方程式为:CO2+4H2![]() CH4+2H2O,已知:①CH4( g) +CO2( g)
CH4+2H2O,已知:①CH4( g) +CO2( g) ![]() 2CO( g)+2H2( g) △H1=+247kJ·mol-1;②CH4(g) +H2O(g)
2CO( g)+2H2( g) △H1=+247kJ·mol-1;②CH4(g) +H2O(g) ![]() CO( g)+3H2(g) △H2=+205kJ mol-1;根据盖斯定律,由①-②×2得反应CO2 (g) +4H2(g)
CO( g)+3H2(g) △H2=+205kJ mol-1;根据盖斯定律,由①-②×2得反应CO2 (g) +4H2(g) ![]() CH4 (g) +2H2O (g) ΔH=△H1-2△H2=+247kJ·mol-1-+205kJ mol-1×2= - 163kJ/mol;(2)①将烟气通入1.0mol·L-1的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液的pH不断减小,向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)molL-1,则生成的硫酸氢根为2×(1.0-0.2)molL-1=1.6molL-1;②发生的主要反应(NH4)2SO3+H2O+SO3=2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液PH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2 n(SO32-),又根据图像曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1。(3)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除率=6×10-4mg/m3×(0.75-0.55)÷0.8s=1.5×10-4mg/(m3s);②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应NH3与NO的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为:2HSO3-+2e-+2H+ ═S2O42-+2H2O;。根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是:2NO + 2S2O42-+2H2O═N2 + 4HSO3-。
CH4 (g) +2H2O (g) ΔH=△H1-2△H2=+247kJ·mol-1-+205kJ mol-1×2= - 163kJ/mol;(2)①将烟气通入1.0mol·L-1的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液的pH不断减小,向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)molL-1,则生成的硫酸氢根为2×(1.0-0.2)molL-1=1.6molL-1;②发生的主要反应(NH4)2SO3+H2O+SO3=2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液PH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2 n(SO32-),又根据图像曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1。(3)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除率=6×10-4mg/m3×(0.75-0.55)÷0.8s=1.5×10-4mg/(m3s);②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应NH3与NO的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为:2HSO3-+2e-+2H+ ═S2O42-+2H2O;。根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是:2NO + 2S2O42-+2H2O═N2 + 4HSO3-。


科目:高中化学 来源: 题型:
【题目】取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属钠熔化 ②在空气中燃烧,放出紫色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色的固体物质,描述正确的是
A. ①② B. ①②③
C. ①④ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A+B =C,下列条件的改变一定能使化学反应速率加快的是
A. 增加A的物质的量B. 升高体系的温度
C. 减少C的物质的量D. 增加体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法错误的是( )
A. 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素
B. 利用CO2合成聚碳酸酯类可降解塑料,有利于减少白色污染
C. 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质
D. 久置的漂白粉变质是因为漂白粉与空气中的O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJ·mol-1。氢气的燃烧热为285.8 kJ·mol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中碳原子和氢原子的个数比
A. 1∶8B. 8∶1C. 4∶17D. 17∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些科学家提出硅是“21世纪的能源”,下列关于硅及其化合物的说法正确的是
A. SiO2是一种酸性氧化物,所以不和任何酸反应
B. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
C. 光导纤维的主要成分是SiO2
D. 自然界中硅元素的储量丰富,主要以硅单质的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
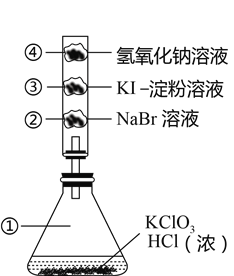
选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 白色 | 紫色 | 白色 |
B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F原子序数依次增大.A的阳离子就是一个质子:B原子的最外层电子数是所在周期数的2倍;C、D在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体:E与A同一主族:F原子的K、L层电子数之和比K、M层电子数之和多l。A、D、E三种元素可形成化合物甲,B、D、E三种元素可形成化合物乙。请回答:
(1)C2的结构式为_______________。
(2)由上述元素组成的既含极性健又含非极性键的无机化合物分子的电子式为__________。
(3)A的单质与D的单质在强酸性条件下构成燃料电池,其正极反应式为__________。
(4)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH-的物质的量浓度c(OH -)甲:c(OH-)乙= ________。
(5)将2.4gB的单质在足量D的单质中燃烧,所得气体通入1L 0.3mol/L的甲溶液中,完全吸收后,溶液中的溶质为______。溶液中所含离子的物质的量 浓度由大到小的顺序为______。
(6)由A、B、C、D四种元素组成的无机酸的酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com