
反应Fe(s)+CO2(g)  FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
科目:高中化学 来源:2014-2015学年黑龙江哈尔滨第三十二中学高二上学期期中考试化学卷(解析版) 题型:选择题
下列说法正确的是v( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.NaHCO3溶液显酸性
D.碳酸钠溶液显碱性,溶液中c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:填空题
(6分)已知反应:
①SO2+2NaOH=Na2SO3+H2O
②SO2+2H2S=3S↓+2H2O
③SO2+Br2+H2O=H2SO4+2HBr
(1)将③反应中的反应物和生成物化学式填入下表。(每个格子只填一种)
类型 | 酸性氧化物 | 电解质 | 非电解质 |
化学式 |
|
|
|
(2)从①反应后的溶液中获取Na2SO3晶体,需进行的操作是 ;
从②反应后的溶液中获取S单质,需进行的操作是 ;
从③反应中提取剩余的Br2,需进行的操作是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.标准状况下,1mol N2和CO混合气体所占的体积约为22.4L
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,
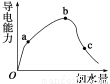
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
A.加热 B.加很稀的NaOH溶液
C.加NaOH固体 D.加水
E.加入锌粒
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:选择题
COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①④⑥ B.①②④ C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:选择题
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.①③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8 g O2的体积为5.6 L
B.标准状况下,22.4 L CCl4所含的分子数为NA
C.标准状况下,1.8 g H2 O中含有电子数为NA
D.常温常压下,10 g氖气含有的原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省宁波市高一上学期期中化学试卷(解析版) 题型:选择题
从1L1mol/LNaOH溶液中取出100ml,下列关于这100ml溶液的叙述中错误的是
A.含NaOH0.1mol B.浓度为1mol/L
C.含NaOH4g D.浓度为0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com