
| A. | 天然的油脂大多数为混甘油酯 | |
| B. | 油脂在碱性条件下水解更彻底,工业应用该反应制肥皂 | |
| C. | 油脂分为液态的油和固体的脂肪 | |
| D. | 油脂没有不饱和双键,所以,油脂不能使高锰酸钾溶液反应 |
分析 A.天然油脂是甘油与不同高级脂肪酸反应生成的混甘油酯;
B.依据油脂在碱性条件下水解生成甘油和高级脂肪酸钠解答;
C.油脂分为油和脂肪;
D.油脂中的油为不饱和高级脂肪酸甘油酯;
解答 解:A.天然油脂大多是由混甘油酯分子构成的混合物,故A正确;
B.油脂水解生成甘油和高级脂肪酸,高级脂肪酸能够与碱中和,使水解平衡正向移动,生成的高级脂肪酸钠为肥皂主要成分,所以工业上用该反应制肥皂,故B正确;
C.油脂分为油和脂肪,油为液体,脂肪为固体,故C正确;
D.油脂中的油为不饱和高级脂肪酸甘油酯,含有碳碳双键,能够被高锰酸钾氧化,而使高锰酸钾褪色,故D错误;
故选:D.
点评 本题考查油脂的结构与性质,难度不大,明确油脂的成分及油脂水解的条件即可答.


科目:高中化学 来源: 题型:解答题
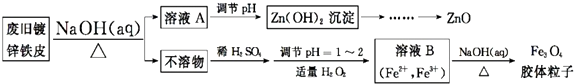
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
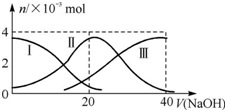 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ | |
| B. | 澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4- | |
| C. | 使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液中:K+、Ca2+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
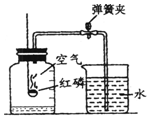 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )| A. | 该实验证明空气中氧气的质量分数约占$\frac{1}{5}$ | |
| B. | 实验时红磷要足量 | |
| C. | 实验前一定要检查装置的气密性 | |
| D. | 红磷燃烧的火焰熄灭后立刻打开弹簧夹 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
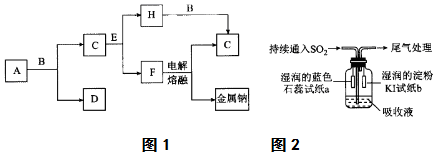
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
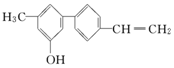
| A. | 完全燃烧时只有二氧化碳和水两种产物 | |
| B. | 由于含有氧元素不是有机物 | |
| C. | 该分子中含有羟基属于醇 | |
| D. | 不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
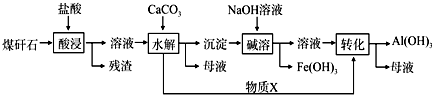
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com