
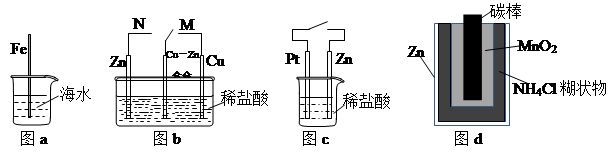
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由连接M改为连接N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Pt上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化性引起的 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:不详 题型:填空题
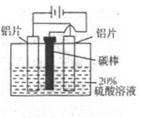
 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.若两电极直接连接,a是食盐水,则发生析氢腐蚀 |
| B.若两电极直接连接,则负极反应一定是:Fe-2e→Fe2+ |
| C.若铁接电源负极,石墨接电源正极,a是食盐水,左侧电极上析出的气泡比右侧电极上的多 |
| D.若铁接电源负极,石墨接电源正极,a是氯化铜,铁上有气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气态电中性基态原子失去电子转化为气态基态正离子需要的最低能量叫做第一电离能 |
B.当碳原子的核外电子排布由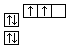 转变为 转变为 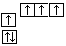 时,碳原子要向外界环境吸收能量 时,碳原子要向外界环境吸收能量 |
| C.电负性的大小也可以作为判断金属性和非金属性强弱的尺度 |
| D.同主族元素从上到下第一电离能逐渐变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C.用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
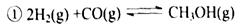


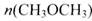 =_________mol。
=_________mol。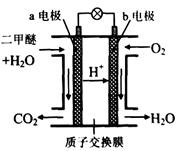
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
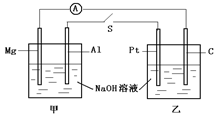
| A.电流计指针不发生偏转 |
| B.Al、Pt两电极有氢气生成 |
| C.甲池pH减小,乙池pH不变 |
| D.Mg、C两电极生成的气体在一定条件下可恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.设想把“H2+Cl2===2HCl”设计成燃料电池,用于工业制盐酸,并进行发电 |
| C.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不变 |
| D.原电池的两极一定是由活泼性不同的两种金属组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com