
| A. | X的氢化物的沸点可能高于Y的氢化物的沸点 | |
| B. | 原子半径比较:X<Y<Z<W | |
| C. | X2H4与H2W都能使溴水褪色,且褪色原理相同 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
分析 X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;
Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;
Y、W质子数之和是Z质子数的2倍,则(8+16)÷2=12,即Z为Mg元素,据此判断即可.
解答 解:X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;Y、W质子数之和是Z质子数的2倍,则(8+16)÷2=12,即Z为Mg元素,
A.X、Y分别为C、O,水分子间存在氢键,则水的沸点较高,常温下呈液态,但是C的氢化物是烃,有气态烃、液态烃、固态烃,所以X的氢化物的沸点可能高于Y的氢化物的沸点,故A正确;
B.电子层数越多,半径越大,同一周期,原子序数越小,半径越大,即原子半径:Mg>S>C>O,故B错误;
C.X2H4与H2W分别为C2H4与H2S,乙烯能够与溴水发生加成反应,硫化氢能够被溴水氧化,褪色原理不相同,故C错误;
D.元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,由于短周期中金属性Na最强,故NaOH碱性最强,不是氢氧化镁,故D错误;
故选:A.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,A为易错点,注意氢键对沸点的影响,也要注意C的氢化物和C的气态氢化物的区别,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向试管中的无色溶液内滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 不能确定原溶液中是否含有NH4+ |
| B | 加热盛有铜与浓硫酸的试管,发现试管底部出现白色固体,直接向试管中加入适量水 | 白色固体溶解,溶液变蓝色 | 白色固体为无水硫酸铜 |
| C | 将稀硫酸酸化的H2O2溶液滴入FeCl2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向蔗糖中加入浓硫酸,并不断用玻璃棒搅拌 | 变黑,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡屎矾中含有极性共价键 | |
| B. | 铜盐溶液可与铁发生置换反应 | |
| C. | 碱式碳酸铜不稳定,受热易分解 | |
| D. | 鸡屎矾投苦酒中发生的是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| Y | ||||
| Q | W | X | Z |
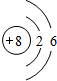 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.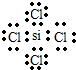 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
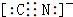 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
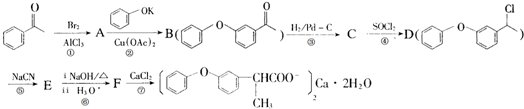
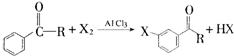
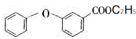
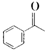 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、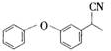 .
.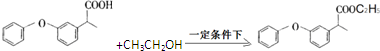 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| B. | 向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-) | |
| C. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com