
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |


科目:高中化学 来源: 题型:
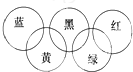 奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| 蓝 | 黄 | 黑 | 绿 | 红 | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、硫酸铵溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、CO2通入过量氢氧化钠溶液中 CO2+2OH-═CO32-+H2O |
| D、CuO与盐酸反应:CuO+2H+═Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
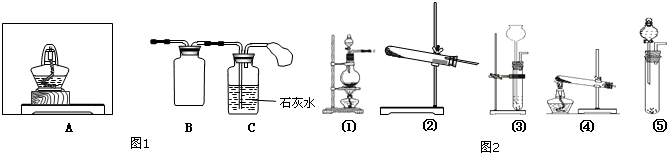
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
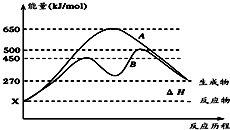 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
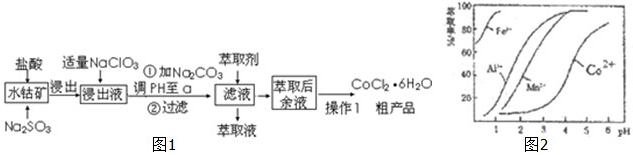
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
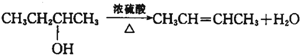
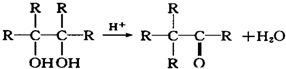

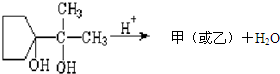
查看答案和解析>>
科目:高中化学 来源: 题型:
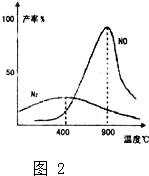
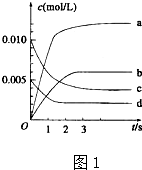 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com