
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:分析 根据题目给出的信息推断,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,故B为P元素;D原子得到一个电子后3p轨道全充满,且原子序数大于P,为Cl元素;A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,分别推断出A为Na、C为S;E4+离子和氩原子的核外电子排布相同,故E为Ti元素;原子序数之和为107,则F为Fe元素.
(1)根据第一电离能递变规律获得答案;
(2)化合物为PCl3,根据价电子对数判断杂化类型和空间构型;氨分子之间能形成氢键,而PH3分子之间没有氢键;
(3)根据Fe元素的原子序数写出价电子排布式;等电子体是指具有相同的原子数和价电子数的原子团;根据电子得失守恒和元素守恒可书写氧化还原反应的离子方程式;
(4)Ti为22号元素,根据Ti元素的原子序数写出价电子排布式;根据均摊法计算出生成物化学式,进而写出化学方程式;根据晶胞结构图可知,每个Ti4+的周围距离最近的氧原子位于晶胞的六个面的面心上,据此判断配位数;晶体密度可以通过摩尔质量和摩尔体积计算得出.
解答 解:(1)第一电离能同周期从左到右呈增大趋势,其中第ⅤA大于ⅥA,
故答案为:Na<S<P<Cl;
(2)PCl3的价电子数=$\frac{5+3}{2}$=4,形成四条新的杂化轨道,价电子数=孤电子对数+配位原子数,即孤电子对数为1,对共价键有排斥作用,氨分子之间能形成氢键,而PH3分子之间没有氢键,所以P元素氢化物的沸点低于其同族上周期元素的氢化物,
故答案为:三角锥形;sp3杂化;不能形成氢键;
(3)Fe元素的原子序数为26,价电子数为8,所以Fe的基态原子价电子排布式为3d64s2,CN-的等电子体为有两个原子,且价电子数为10,其等电子体为N2或CO,CN-中加入浓的双氧水,生成可溶性碳酸盐及氨气,其反应的离子方程式为CN-+H2O2+OH-=CO32-+NH3↑,
故答案为:3d64s2;N2或CO;CN-+H2O2+OH-=CO32-+NH3↑;
(4)①Ti为22号元素,Ti基态原子的价电子排布为d24s2,②晶体中Ba位于顶点,$8×\frac{1}{8}$=1,O位于面心6×$\frac{1}{2}$=3,Ti位于体心,所以晶体化学式为BaTiO3,根据反应物和生成物可知化学方程式为TiO2+BaCO3=BaTiO3+CO2↑;③Ti4+位于体心,与六个位于面心的O邻接,所以Ti4+的配位数为6;晶胞中含有一个微粒,晶胞体积为(a×10-7)3,则ρ=$\frac{M}{V{\;}_{m}}$=$\frac{M}{N{\;}_{A}×(a×10{\;}^{-7})^{3}}$g/cm3=$\frac{M×1{0}^{21}}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:d24s2;TiO2+BaCO3=BaTiO3+CO2↑;6;$\frac{M×1{0}^{21}}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构与性质,涉及元素周期表、元素周期律、杂化理论、化学键、分子结构与性质、晶胞计算等,难度较大,对学生的思维能力、空间想象能力有一定的要求.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的球棍模型为: | B. | 次氯酸的结构式为:H一C1一O | ||
| C. | 淀粉的结构简式为:[C6H12O6]n | D. | 乙烯的电子式为: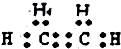 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3-→NaOH | B. | CaCO3-→Ca(OH)2 | C. | NaNO3-→NaCl | D. | CuO-→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
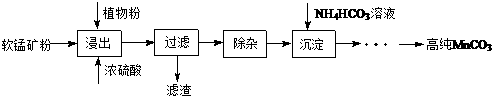
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com