
 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:分析 (1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,2min后X、Y物质的量不变,属于可逆反应,根据参加反应的物质的物质的量之比等于化学计量数之比确定化学计量数;
(2)2min末X的物质的量为0.7mol,根据v=$\frac{△c}{△t}$计算X表示的速率;
(3)Y的转化率=$\frac{反应的Y物质的量}{Y起始物质的量}$×100%;
(4)①降低温度,反应速率减小;
②保持容器的体积不变,增加X的物质的量,X浓度增大,反应速率增大;
③保持容器的体积不变,增加He,反应混合物各组分浓度不变;
④增大容器的体积,压强减小,各组分浓度减小.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,2min后X、Y物质的量不变,属于可逆反应,当反应进行到2min时,△n(Y)=0.1mol,△n(Z)=0.2mol,△n(X)=0.3mol,则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:Y+3X?2Z,
故答案为:Y+3X?2Z;
(2)2min末X的物质的量为0.7mol,X表示的反应速率=$\frac{\frac{1mol-0.7mol}{2L}}{2min}$=0.075mol/(L•min),
故答案为:0.075mol/(L•min);
(3)当反应进行到2min时,△n(Y)=0.1mol,则Y的转化率为$\frac{0.1mol}{1mol}$×100%=10%,
故答案为:10%;
(4)①降低温度,反应速率减小,故答案为:减小;
②保持容器的体积不变,增加X的物质的量,X浓度增大,反应速率增大,故答案为:增大;
③保持容器的体积不变,增加He,反应混合物各组分浓度不变,反应速率不变,故答案为:不变;
④增大容器的体积,压强减小,各组分浓度减小,反应速率减小,故答案为:减小.
点评 本题考查化学平衡计算、反应速率计算与影响因素,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.33 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 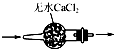 干燥SO2气体 | |
| B. | 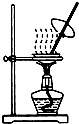 蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. | 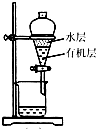 分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 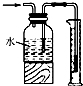 测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
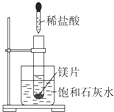 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用KSCN溶液检验${\;}_{26}^{45}$FeCl3和${\;}_{26}^{56}$FeCl3 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 副族元素中没有非金属元素,所以又称过渡金属 | |
| D. | F-与K两种微粒之间可以形成离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com