
����˵���������
A����֪298Kʱ��2SO2(g)��O2(g) 2SO3(g) ��H=��197kJ/ mol���Ը��Ȼ�ѧ����ʽ����Ϊ���ڸ������£����ܱ�������ͨ��2ĦSO2��1ĦO2���ﵽƽ��ʱ�ų�������197 kJ
B��CO(g)��ȼ������283.0kJ/mol����2CO2(g)===2CO(g)��O2(g)��Ӧ�ġ�H��+��2��283.0��kJ/mol
C�����ȷ�Ӧ��ָ��Ӧ�������е����������������������е��������������ǿ���Ӧ�����Ƿ���Ҫ����
D�������з�Ӧ��HCl(aq) + NaOH(aq)=NaCl(aq) + H2O(l) ��H=��Q1kJ/mol
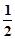 H2SO4(Ũ)+NaOH(aq)=
H2SO4(Ũ)+NaOH(aq)= 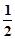 Na2SO4(aq)+H2O(l)
��H=��Q2kJ/mol
Na2SO4(aq)+H2O(l)
��H=��Q2kJ/mol
������Ӧ������Һ�н��У���Q2>Q1
 ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
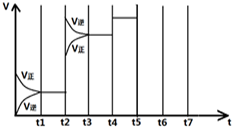 ��һ�������·�����ѧ��Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-197kJ/mol�������ݻ���Ϊ1L�ļס������������������������·ֱ�������壬����ƽ��ʱ����Ӧ�ų����ȣ�Q������ƽ��ʱ��ת���ʣ�X�����±���ʾ��
��һ�������·�����ѧ��Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-197kJ/mol�������ݻ���Ϊ1L�ļס������������������������·ֱ�������壬����ƽ��ʱ����Ӧ�ų����ȣ�Q������ƽ��ʱ��ת���ʣ�X�����±���ʾ��| ���� | ��ʼʱ�����ʵ��� | ����ƽ��ʱ�ų���������QkJ�� | ƽ��ʱSO2ת���� ��X�� | |||
| SO2 | O2 | SO3 | N2 | |||
| �� | 2 | 1 | 0 | 0 | Q1 | X1 |
| �� | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�����и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ѡ����
����˵���������
A����C(s) +H2O(g)  CO(g) + H2(g)��Ӧ��ϵ�У�����̼��������Ѹ���������Ӧ����
CO(g) + H2(g)��Ӧ��ϵ�У�����̼��������Ѹ���������Ӧ����
B���صĽ����Ա���ǿ�����Լ���ˮ�ķ�Ӧ���Ƶķ�Ӧ����
C����ѹǿ��ͬ�����£��ṹ���Ƶ�CH4��SiH4��GeH4�ķе��������ߣ����Խṹ���Ƶ�HF��HCl��HBr��HI�ķе�Ҳ��������
D����۳��Ͻ��̻��ԭ������۷۳��������������Ӵ�������������ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�γ��и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ѡ����
����ȼ�ϵ�������ں���ɻ�����30%KOH��ҺΪ�������Һ�����ֵ����ʹ��ʱ�ĵ缫��Ӧ���£�2H2+4OH����4e��=4H2O��2H2O+O2+4e��==4OH����
�ݴ��жϣ�����˵���������
A��H2�ڸ�������������Ӧ B������ʱ�ܷ�ӦΪ��2H2+ O2==2H2O
C��ȼ�ϵ�ص�����ת����Ϊ100% D������Ϊ����Ⱦ��ˮ���������Ѻõ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��㶫ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ�ѡ����
����ͬ�����£�����˵���������
A�������ڱ���ʳ��ˮ�е��ܽ��С���ڴ�ˮ�е��ܽ��
B��NO�����ſ����������ռ�
C��̼������Աȹ���ǿ
D��SO2 �Ĵ����ŷŻ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com