

 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CO2↑
+CO2↑ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$ +H2O
+H2O $→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
$→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O.
+2H2O. 分析 乙烯和溴发生加成反应生成A为BrCH2CH2Br,由A→D的系列转化及C、D分子式可知,C中醛基氧化生成D,则A在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生催化氧化生成C为OHC-CHO,C中部分醛基被氧化生成D为OHC-COOH;结合K的结构及J的分子式可知,反应⑧为D中醛基与I发生加成反应生成J ,J中的醇羟基被氧化生成K,由K的结构简结合信息①可知,K在一定条件下发生信息①中脱羧反应生成L为
,J中的醇羟基被氧化生成K,由K的结构简结合信息①可知,K在一定条件下发生信息①中脱羧反应生成L为 ,结合信息②及M的分子式,可知M的结构简式为:
,结合信息②及M的分子式,可知M的结构简式为: ,据此解答.
,据此解答.
解答 解:(1)根据以上分析,A为BrCH2CH2Br,名称是1,2-二溴乙烷,D为OHC-COOH,含有的官能团名称是醛基和羧基,故答案为:1,2-二溴乙烷;醛基和羧基;
(2)④为C中部分醛基被氧化生成D为OHC-COOH,则反应类型是氧化反应,⑧为D与I发生加成反应生成J,故答案为:氧化反应;加成反应;
(3)反应B→C的化学方程式为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHC-CHO+2H2O,
L为 ,M为:
,M为: ,则L→M的化学方程式为:
,则L→M的化学方程式为:
2 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O;
+2H2O;
故答案为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHC-CHO+2H2O;
2 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O.
+2H2O.
点评 本题考查有机物的推断,充分利用有机物分子式与结构简式进行分析,需要学生对给予的信息进行利用,熟练掌握官能团想性质与转化,较好地考查学生自学能力与分析推理能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 结 论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液中,铁锈逐渐溶解 | NH4Cl显酸性 |
| C | Ba(NO3)2溶液中通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体,有白色沉淀 | 一定含有AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
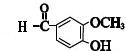
 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酸性溶液中:Al3+、Cl-、Fe3+、SO42- | |
| B. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| C. | 0.1mol•L-1NaHCO3溶液中:K+、AlO2-、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe3+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,乙烯对水果具有催熟功能.
,乙烯对水果具有催熟功能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “接触法”制H2SO4时,催化氧化阶段的反应原理为:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0 | |
| B. | 海水提镁的主要步骤为:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸钙 | |
| D. | 黏土的主要成分是三氧化二铝. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com