
| A. | 反应前酸、碱溶液的温度要相同 | |
| B. | 环形玻璃棒搅拌能加快反应速率,减小实验误差 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 为了使反应更完全,可以使酸或碱适当过量 |
分析 A.反应前酸碱溶液的温度相同时,误差较小;
B.玻璃棒不导热,且玻璃棒搅拌能加快反应速率缩短反应时间,热量散失减少;
C.分次加入混合时,容易造成热量损失;
D.一种物质过量时能使另一种物质反应更充分.
解答 解:A.如果反应前酸碱温度不同无法计算反应初始温度,从而增大误差,所以反应前酸碱溶液的温度相同时,误差较小,故A正确;
B.玻璃棒不导热,且玻璃棒搅拌能加快反应速率缩短反应时间,热量散失减少,则误差较小,故B正确;
C.分次加入混合时,容易造成热量损失,导致误差增大,故C错误;
D.一种物质过量时能使另一种物质反应更充分,测量更准确,所以为了使反应更完全,可以使酸或碱适当过量,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及实验操作,明确实验原理及物质性质是解本题关键,侧重考查实验操作及实验评价,注意B中不能使用金属棒搅拌,题目难度不大.


科目:高中化学 来源: 题型:解答题

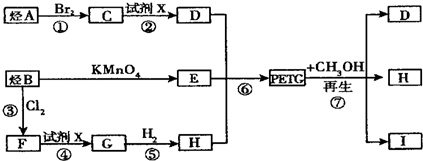
 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$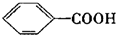
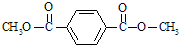 .
.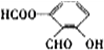 、
、 、
、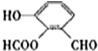 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若n(Cu2+):n(IO3-)=1:1,则每生成1molCuI转移6mol电子 | |
| B. | 若n(Cu2+):n(IO3-)=1:2,则每生成1molCuI转移12mol电子 | |
| C. | CuI既是氧化产物又是还原产物 | |
| D. | HI只有还原性没有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2 和 D2 互为同位素 | |
| B. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| C. | 甲苯和 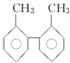 互为同系物 互为同系物 | |
| D. | 金刚石、石墨和“足球烯”(分子式为 C60)为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com