
【题目】下列选项与胶体知识无关的是( )
A. 胶体中分散质粒子的直径大于溶液中分散质的粒子直径
B. 向饱和的氯化铁溶液中加入氢氧化钠溶液得到红褐色沉淀
C. 黄河入海口处形成三角洲
D. 氢氧化铁溶胶、稀豆浆、云雾等均具有丁达尔现象
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是(填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 . 其中由水电离出的c(H+)=mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是(填字母).
A.![]()
B.![]()
C.c(H+)与c(OH﹣)的乘积
D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈性,请用离子方程式解释其原因 , 混合溶液中各离子浓度由大到小的顺序是 .
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11.(混合溶液体积变化忽略不计),应加 NaHSO4mL(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金.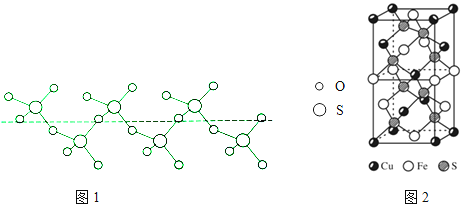
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是
(2)S位于周期表中 族,该族元素氢化物中,H2Te比H2S沸点高的原因是 ,H2O比H2Te沸点高的原因是
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是 .
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层电子排布为 ,Cu2+有 个未成对电子.
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与 个S原子相连,列式计算晶体密度 ρ= gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,观察到的现象是_________、____________、________。说明反应放热。

乙方案:将盛放有生石灰的小试管插入带有支管的试管中,支管接①,用胶头滴管向小试管中缓缓滴入水,①中看到的现象是________________________________________,说明该反应放热。
丙方案:盛放有生石灰且带支管的试管中,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是___________________________,说明反应放热,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X,Y,Z,W的原子序数依次增大,四种元素同周期,X的金属性再同周期元素中最强,Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位,W的最高价氧化物的水化物的化学式为HnWO2n+2 , 下列说法正确的是( )
A.简单离子半径:X<Y<W
B.Y,Z两种元素的氧化物均具有两性
C.X,W分别形成的氢化物中所含化学键种类相同
D.Z,W形成化合物的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质.处理C物质可得到有价值的化学品,写出其中1种酸和1种盐的名称 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.判断单质A的元素在周期表中的位置是 .写④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .D的化学式是 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 .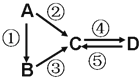
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 摩尔是物质的量的单位
B. 电子转移是氧化还原反应的本质
C. 熔融状态下或水溶液中能导电的化合物称为电解质
D. 得电子的物质被还原,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,1 mol水占的体积是22.4 LB.1 mol H+的质量是1 g
C.1 L 1 mol/L盐酸溶液中,有1molHCl分子D.二氧化硫的摩尔质量是64 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com