
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
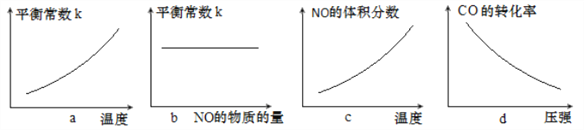
【答案】 4H2(g)+2CO(g)+1/2O2(g) ![]() HOCH2CH2OH(l)+2H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < a bc 0.01mol··L-1·min-1 100 增大 b
HOCH2CH2OH(l)+2H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < a bc 0.01mol··L-1·min-1 100 增大 b
【解析】(1)已知反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
根据盖斯定律,由I![]() + II+ III得反应4H2(g)+2CO(g)+
+ II+ III得反应4H2(g)+2CO(g)+ ![]() O2(g)
O2(g) ![]() HOCH2CH2OH(l)+2H2O(g) △H=(
HOCH2CH2OH(l)+2H2O(g) △H=(![]() a+b+c)kJ·mol-1;该反应为熵减的反应△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;(2)①a. CO 的质量不再变化,说明反应已达平衡状态,故选; b. 该反应在恒容条件下进行且参与物质不完全为气体,气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,故选;c.单位时间内生成 CO 和 NO 的物质的量相等,说明正逆反应速率相等,反应达平衡状态,故选;d. CO 和 CH3ONO 的投料相等且在反应中计量数相等,故两者的浓度比始终不变,不能作为平衡状态的判断依据,故不选。答案选a bc;
a+b+c)kJ·mol-1;该反应为熵减的反应△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;(2)①a. CO 的质量不再变化,说明反应已达平衡状态,故选; b. 该反应在恒容条件下进行且参与物质不完全为气体,气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,故选;c.单位时间内生成 CO 和 NO 的物质的量相等,说明正逆反应速率相等,反应达平衡状态,故选;d. CO 和 CH3ONO 的投料相等且在反应中计量数相等,故两者的浓度比始终不变,不能作为平衡状态的判断依据,故不选。答案选a bc;
②设平衡转化率为x,则 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g)
CH3OOCCOOCH3(l) + 2NO(g)
开始时的浓度(mol/L) 0.2 .02 0 0
改变的浓度(mol/L) 0.2x 0.2x 0.1x 0.2x
平衡时的浓度(mol/L)0.2-0.2x 0.2-0.2x 0.1x 0.2x
10min 达到平衡时CO的体积分数与NO的体积分数相等,则0.2-0.2x=0.2x,解得x=0.5;10min 内该反应的速率 ν(NO)= ![]() 0.01mol··L-1·min-1;该温度下化学平衡常数 K=
0.01mol··L-1·min-1;该温度下化学平衡常数 K=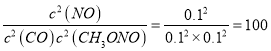 ;若此时向容器中再通入0.4 mol NO,恒容条件下相当于增大压强,平衡向气体体积缩小的正方向移动,NO的体积分数增大;故新平衡时 NO的体积分数与原平衡时相比增大;③a.该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,选项a错误;b平衡常数只与温度有关,与浓度无关,故NO的浓度变化,K值保持不变,选项b正确;c.该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,选项c错误;d.该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,选项d错误;答案选b。
;若此时向容器中再通入0.4 mol NO,恒容条件下相当于增大压强,平衡向气体体积缩小的正方向移动,NO的体积分数增大;故新平衡时 NO的体积分数与原平衡时相比增大;③a.该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,选项a错误;b平衡常数只与温度有关,与浓度无关,故NO的浓度变化,K值保持不变,选项b正确;c.该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,选项c错误;d.该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,选项d错误;答案选b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是某反应的微观示意图,下列有关说法不正确的是

A. 生成的物质都是氧化物
B. 反应前后原子的种类不变
C. 该反应的基本类型属于置换反应
D. 反应方程式为2H2S+3O2 ![]() 2SO2+2H2O
2SO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
磷及其化合物在工农业生产上应用非常广泛。
(1)磷元素位于周期表的_______区,基态磷原子价层电子排布图________,最高能层符号________。
(2)磷的三种同素异形体的结构如下图所示。

①三种同素异形体中能导电的是_______(填名称)。
②白磷易溶于CS2,其原因是___________。
(3)磷酸与Fe3+可形成H3[Fe(PO4)2],Fe、P、O电负性由大到小的顺序是________。与PO43-空间构型相同的分子和阴离子分别是________(各举1例)。
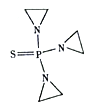
(4)噻替哌的结构简式如右图所示,其中氮原子的杂化轨道类型为_______,1mol噻替哌中含有的σ键数目为______。
(5)磷化铟(InP)是一种半导体材料,可用于光纤通信技术,其晶胞结构如图所示。
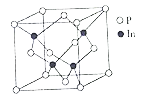
①结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,晶胞中P原子的坐标参数分别有:P(0,0,0),P(![]() ,0,
,0, ![]() );P(0,
);P(0, ![]() ,
, ![]() )等,则距离上述三个P原子最近且等离的In原子的坐标参数为_____。
)等,则距离上述三个P原子最近且等离的In原子的坐标参数为_____。
②已知晶胞参数a=0.587m,则InP晶体的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是__________。
(3)D装置中MnO2的作用是___________。
(4)燃烧管中CuO的作用是_________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为________。
(6)要确定该物质的分子式,还要知道该物质的______,经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 0.2 mol/L CaCl2溶液中含有氯离子的数目为0.4NA
B. 18 g D2O中所含电子数为10NA
C. 2.24 L N2和O2的混合气体中分子数为0.2NA
D. 标准状况下,33.6 L SO3中含有氧原子的数目大于4.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
(1)![]() _________________
_________________
(2)CH3CH(CH3)C(CH3)2CH2CH3 ____________________________
(3)2,2-二甲基-3-乙基己烷 _________________
(4)2-甲基-2-丁烯_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com