
【题目】海水是巨大的资源宝库:从海水中提取食盐和溴的过程如下:
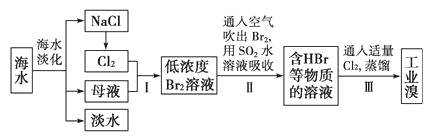
下列说法错误的是
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.电解熔融的氯化钠是一个将电能转化为化学能的过程
C.步骤Ⅱ中将Br2还原为Br-的目的是富集溴元素
D.向母液中加入石灰乳可得到Mg(OH)2,工业上常用电解熔融的Mg(OH)2来制取镁
科目:高中化学 来源: 题型:
【题目】某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:
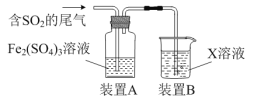
(1)装置A中SO2与Fe2(SO4)3溶液中反应生成FeSO4,写出该反应的化学方程式:___。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___;若要检验SO2是否过量,可用试剂为___。
(3)装置B中所用X溶液为___,作用是___。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol·L-1Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。请通过计算确定FeSO4的物质的量浓度___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,Y的氧化物随意排放易形成酸雨,下列说法不正确的是:
![]()
A.化合物XZ3分子中只存在极性共价键
B.X、Y、Z三种元素分别形成的含氧酸不一定都是强酸
C.因为非金属性Z>Y,所以水溶液中酸性HZ>H2Y
D.X的最高价氧化物对应的水化物和X的简单氢化物能形成盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
A.为提高SO2转化率,可以再加入SO2B.平衡时放出197kJ热量
C.平衡时再充入O2,则v正增大,v逆减小D.平衡时SO2和SO3共2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量可以衡量国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH ③已知乳酸E的结构简式为
2CH3COOH ③已知乳酸E的结构简式为![]() ,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
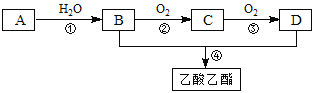
回答下列问题:
(1)A为______________(填结构简式) C为________________(填名称)
(2)E分子中所含有的官能团是_______________、________________(填名称)
(3)写出第②和④步反应的化学方程式:
②的方程式______________________________________________;反应类型_________
④的方程式______________________________________________;反应类型__________
(4)写出E和足量钠反应的方程式__________________________________________。
(5)写出两个E分子在一定条件下反应生成六元环状酯的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如下:

(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是
A. 操作I增大NaOH溶液用量可提高Al2O3的浸取率
B. 操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C. 通入过量CO2的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 加入的冰晶石目的是降低Al2O3的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN + NaOH + H2O=NaAlO2+ NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
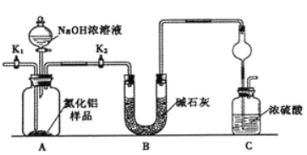
(1)上图C装置中球形干燥管的作用是________________________。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__。
(3)若去掉装置B,则导致测定结果________(填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见__________________________。
(方案2)按以下步骤测定样品中A1N的纯度:
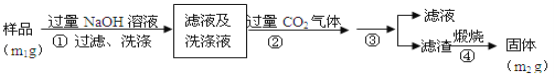
(4)步骤②生成沉淀的离子方程式为_________________________________。
(5)A1N的纯度是___________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g),下列能够标志反应达到平衡状态的是( )
H2(g)+I2(g),下列能够标志反应达到平衡状态的是( )
A. HI、H2、I2的浓度相等
B. 混合气体的总压不变
C. 混合气体的颜色不变化
D. v(HI):v(H2):v(I2)=2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用NaNO2氧化酸性溶液中的KI:2I— + NO2—+ 2H+ = I2 + NO↑+ H2O
B. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4+ + OH— ![]() NH3 ↑+ H2O
NH3 ↑+ H2O
C. 将过量SO2通入冷氨水中:SO2 + NH3·H2O = HSO3- + NH4+
D. 用稀硝酸洗涤试管内壁的银镜:Ag + 4H+ + NO3—= Ag+ + NO↑+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com