
| 选项 | A | B | C | D |
| 实验 | 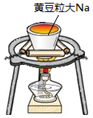 | 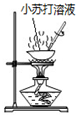 | 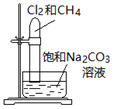 | 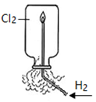 |
| 目的 | Na在空气中燃烧 | 提取NaHCO3晶体 | CH4与Cl2取代反应 | H2在Cl2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 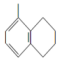 所有碳原子可能在同一平面上 所有碳原子可能在同一平面上 | |
| B. | 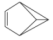 的一氯代物有4种 的一氯代物有4种 | |
| C. | 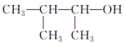 的命名为2,3-二甲基-l-丙醇 的命名为2,3-二甲基-l-丙醇 | |
| D. | 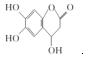 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴:一般需要经过浓缩、氧化、提取三个步骤 | |
| B. | 合成氯化氢:通入H2的量略大于C12,可以使平衡正移 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
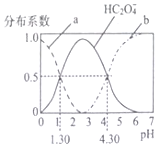 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )| A. | 曲线a代表H2C2O4,曲线b代表C2O42- | |
| B. | 常温下0.1mol/L的NaHC2O4溶液显酸性 | |
| C. | 常温下,H2C2O4的电离平衡常数Ka2=10-4..30 | |
| D. | pH从1.30~4.30时,$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向二氧化锰固体中加入浓盐酸后加热,将产生的气体通入淀粉碘化钾溶液液 | 溶液变蓝 | Cl2具有氧化性 |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水 | 溴水褪色 | SO2具漂白性 |
| C | 向蔗糖溶液中加稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 溶液变蓝 | 蔗糖水解产物没有还原性 |
| D | 无水乙醇与浓硫酸共热170℃,将产生的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 乙烯可被化酸性高锰酸钾氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 92g NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 1.7g H2O2中含有的电子数为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com