
����Ŀ��â����ѧʽΪNa2SO410H2O����ɫ���壬������ˮ����һ�ֲַ��ܹ㷺�������ο����С��ͬѧ�������ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
�ٸõ��۵�������ӦʽΪ �� ��ʱͨ�������ӽ���Ĥ�������������������������=����ͨ�������ӽ���Ĥ����������
���Ƶõ�����������Һ�ӳ��ڣ��A������B������C����D����������
��ͨ�翪ʼ������������ҺpH�������������С�����䡱����
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ���֪H2��ȼ����Ϊ285.8kJmol��1���ȼ�ϵ�ع�������36g H2Oʱ��������kJ������ת��Ϊ���ܣ�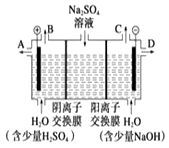
���𰸡�4OH����4e��=2H2O+O2��������D������571.6
���������⣺�ٵ��ʱ��������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2�����������������ӷŵ磬�������������������ƶ������������ӷŵ磬����������������ƶ�������ͨ����ͬ����ʱ��ͨ�������ӽ���Ĥ��������С��ͨ�������ӽ���Ĥ����������
�ʴ�Ϊ��4OH����4e��=2H2O+O2���������������������ӷŵ磬��NaOH���������ɣ���ͼ��֪��D�������������Ƶõ�����������Һ��D���ڵ������ʴ�Ϊ��D���۵��������������������õ����ӷ�����ԭ��Ӧ���ƻ���ˮ�ĵ��룬��Һ������������Ũ��������ҺpH���ߣ�
�ʴ�Ϊ������H2��ȼ����Ϊ285.8kJ/mol����2H2��g��+O2��g��=2H2O��l����H=��571.6kJ/mol����ȼ�ϵ�ع�������36g H2O��n��H2O��= ![]() =2mol����ȼ�յ��ȷ���ʽ��֪������2molH2O�ų�571.6kJ������������������571.6kJ������ת��Ϊ���ܣ�
=2mol����ȼ�յ��ȷ���ʽ��֪������2molH2O�ų�571.6kJ������������������571.6kJ������ת��Ϊ���ܣ�
�ʴ�Ϊ��571.6��
�ٵ��ʱ����Һ�е����������ӵķŵ�����������������ӵķŵ�������������ʧ���ӷ���������Ӧ�������������ӵ��ƶ�����ͨ����ͬ����ʱ���������ӽ����ĸ����жϣ��������������ӷŵ磬��NaOH���������ɣ��۵��������������������õ����ӷ�����ԭ��Ӧ���ƻ���ˮ�ĵ��룬��Һ������������Ũ��������ҺpH���ߣ��ܽ��ȼ���ȷ���ʽ����ط�Ӧ���㣮


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ����У������ɽ���������ֱ�ӻ����Ƶã������ɽ��������ᷴӦ�Ƶõ����� ��
A. CuCl2 B. MgCl2 C. FeCl2 D. FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ������һ���ɷ��ӹ��� B. ͬ�ַ��ӹ��ɵ�����һ���Ǵ�����
C. �����϶�����������Ԫ����� D. ������Ԫ�صĻ����ﶼ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
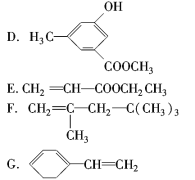
����Ŀ�����л������У��е��ж�������š�

�����������
(1)����������____________(����ţ���ͬ)��
(2)����±��������____________��
(3)���Կ���ȩ����____________��
(4)���Կ���������____________��
(5)�����ڴ��������������____________��
(6)�����ڷ�������������____________��
(7)���ڷ����廯�������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1molSiO2������������ֱ�������NaOH��Һ�������ϣ���ַ�Ӧ��ǰ�߿ɵõ�11.2L���壨��״���������߿ɵõ�6.72L���壨��״��������μӷ�Ӧ��n��HCl����n��NaOH��֮��Ϊ�� ��
A.1��1
B.1��2
C.2��1
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ����������ȷ���ǣ� ��
A. 1 mol�� B. 1 mol O2 C. 1 mol O D. 1 mol O2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ѧƽ��mA��g��+nB��g��pC��g��+qD��g������ͼ��ʾ����A��ת������ѹǿ���¶ȵĹ�ϵ��������ȷ���ǣ� �� 
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com