
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
分析 A.氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3;
B.胶体分散系具有丁达尔效应;
C.二氧化硅可以和唯一的酸HF酸反应;
D.氢氧化钠是强碱具有强腐蚀作用;
解答 解:A.碱性气体为氨气,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的化学方程式为:NaCN+H2O2+H2O=NaHCO3+NH3,降低毒性,故A正确;
B.水玻璃是硅酸钠的水溶液,无丁达尔效应,故B错误;
C.二氧化硅可以和唯一的酸HF酸反应,可以用石英制造耐酸容器,但是不能盛氢氟酸,故C错误.
D.氢氧化钠的腐蚀性过强,对胃的刺激性过大,不能用于治疗胃酸过多,故D错误.
故选A.
点评 本题考查较为综合,涉及氰化物、胶体、二氧化硅、氢氧化钠的性质等知识,为高频考点,有利于培养学生的良好的科学素养,提高学生的学习的积极性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
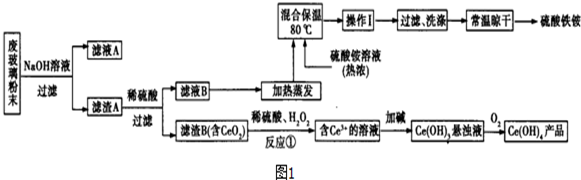
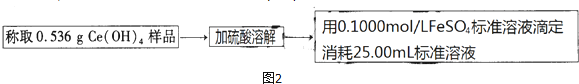
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
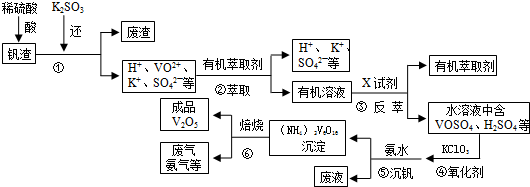
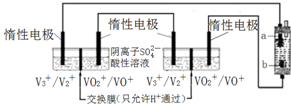
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
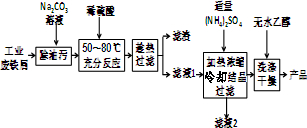
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
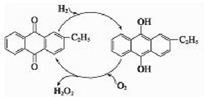 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{5}$×100% | B. | $\frac{2ab}{5}$×100% | C. | $\frac{2ab}{5b}$×100% | D. | $\frac{ab}{5a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com