
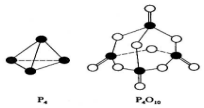
 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
分析 反应热△H=反应物总键能-生成物总键能,据此计算判断,注意每摩尔P4中含有6molP-P键.
解答 解:各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=-(4c+12b-6a-5d)kJ•mol-1,该反应为放热反应,所以放出(4c+12b-6a-5d)kJ热量;
故选:B.
点评 本题考查反应热与化学键键能的关系、反应热的计算,题目难度中等,注意从物质能量、键能理解反应热,侧重于考查学生的分析能力和计算能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用新制的氢氧化铜不能区分乙醇,乙酸 | |
| B. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 | |
| C. | 近日,南充周边地市发生人感染H7N9禽流感病毒病例,该病毒可被高温和紫外线杀灭,利用了蛋白质变性的原理 | |
| D. | CH4和C10H22互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中共用电子对为3NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为0.1NA | |
| C. | 常温常压下,分子总数为NA的NO2和CO2混合气体中含有氧原子数为2NA | |
| D. | 78g苯中含有C=C键数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量NaOH溶液反应转移0.2×6.02×1023个电子 | |
| B. | 1mol羟基中含有的电子数目为9×6.02×1023个 | |
| C. | 标准状况下,2.24L辛烷含有0.8×6.02×1023个碳原子 | |
| D. | 1L 0.50mol/L Na2CO3溶液中含有1.5×6.02×1023个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H 1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(s)+O2(g)=SO2(g)△H 1; S(g)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H 1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H 1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 由NaCl制漂白剂:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | 由铝土矿冶炼铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| D. | 合成NH3:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com