
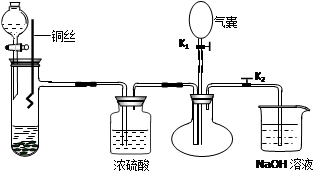
 3Cu + 8 H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O(3)充分反应后烧瓶中若有一氧化氮气体,当打开K1,鼓入空气,NO会与氧气反应生成红棕色的二氧化氮气体,所以若烧瓶中气体由无色红棕色说明产生了NO。(4)氮的氧化物属于大气污染物,会导致硝酸型酸雨,所以氮的氧化物不能直接排入空气中,NaOH溶液的作用就是吸收二氧化氮,防止污染环境。
3Cu + 8 H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O(3)充分反应后烧瓶中若有一氧化氮气体,当打开K1,鼓入空气,NO会与氧气反应生成红棕色的二氧化氮气体,所以若烧瓶中气体由无色红棕色说明产生了NO。(4)氮的氧化物属于大气污染物,会导致硝酸型酸雨,所以氮的氧化物不能直接排入空气中,NaOH溶液的作用就是吸收二氧化氮,防止污染环境。

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.用Zn与稀H2SO4反应制H2 |
| B.用CaO与浓氨水反应制NH3 |
| C.用Cu与稀HNO3反应制NO |
| D.用MnO2与浓HCl反应制C12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.浓硝酸和铜反应制备NO2 |
| B.浓氨水和生石灰反应制备氨气 |
| C.锌和盐酸反应制备氢气 |
| D.碳酸钙和盐酸反应制备二氧化碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
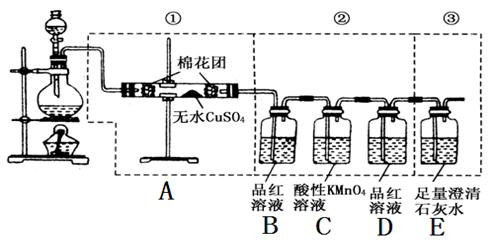
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
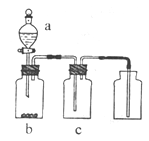
| | 气体 | a | b | C |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | CO2 | 稀硫酸 | Na2CO3固体 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
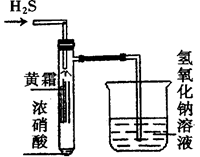

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
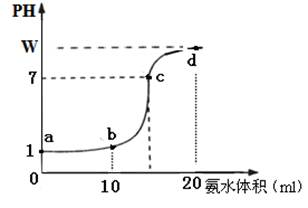
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
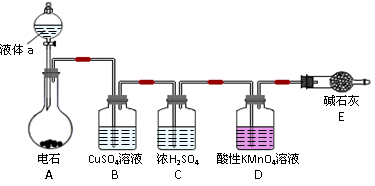
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
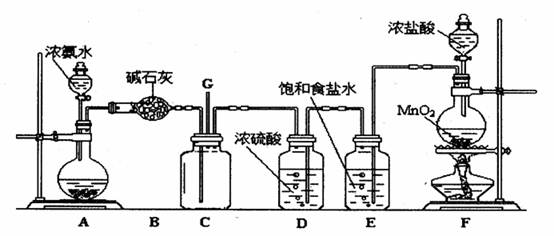
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com