
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0) NH4++NH2-��
NH4++NH2-����1�����ȣ�1�֣���Ѱ�ҳ������ܷ�����Ӧ�Ĵ�����1�֣���
��2���ٽ�������ѹʹ��Һ����Ȼ���������������������������������̼�ڿ�����ȼ�գ���ȥCO2����1�֣���
��C(s)+ H2O (g) CO+ H2(1��)��CO+ H2O (g)
CO+ H2(1��)��CO+ H2O (g) CO2+ H2O(1��)����������2�֣���
CO2+ H2O(1��)����������2�֣���
��3���� K= c(NH4+)?c(NH2-)(1��) ��a(2��)
��4��NH4++ NH2-��2NH3(2��)
���������������1�����ݱ������ݣ��¶����ߣ�ƽ�ⳣ�����ӣ�˵�������̵������ȷ�Ӧ���˹��̵���ũҵ����ʮ���ش��ݱ������ݣ�����֪�ϳɰ�����Ҫ���о�������Ѱ�ҳ������ܷ�����Ӧ�Ĵ�����
��2�����Կ���Ϊԭ���Ʊ�N2���䷽���ǽ�������ѹʹ��Һ����Ȼ���������������������������������̼�ڿ�����ȼ�գ���ȥCO2�������Խ�̿��ˮΪԭ���Ʊ�H2����Ӧԭ��ΪC(s)+ H2O (g)=CO+ H2(1��)��CO+ H2O (g)=CO2+ H2O��CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC��CO(aq)+Q(Q>0)����Ӧ�Ƿ��ȷ�Ӧ�� Ҫ�ӳ��Ӻ����Һ�С���������������ͭ���������½�ѹ����ʹƽ�����Ƽ��ɡ�
Cu(NH3)2AC��CO(aq)+Q(Q>0)����Ӧ�Ƿ��ȷ�Ӧ�� Ҫ�ӳ��Ӻ����Һ�С���������������ͭ���������½�ѹ����ʹƽ�����Ƽ��ɡ�
��3��NH3+NH3 NH4++NH2-����Һ�������ӻ����Ա�ʾΪK= c(NH4+)?c(NH2-)��������Һ���ܵ����NH2-��������NaNH2ʱ�����NH2-�����������ӵ����϶���ȣ�������ԭNH2-ʱ������c(Na+)<(NH2-) ,a����
NH4++NH2-����Һ�������ӻ����Ա�ʾΪK= c(NH4+)?c(NH2-)��������Һ���ܵ����NH2-��������NaNH2ʱ�����NH2-�����������ӵ����϶���ȣ�������ԭNH2-ʱ������c(Na+)<(NH2-) ,a����
��4������Һ����NaNH2��NH4Cl������ȫ���룬���ñ�NaNH2Һ����Һ�ζ�δ֪Ũ��NH4ClҺ����Һʱ����Ӧ�����ӷ���ʽΪNH4++ NH2-��2NH3��
���㣺���⿼�黯ѧƽ�ⳣ�������ã�ƽ���ƶ��͵���ƽ������ӵķ�����


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1.0 L�ܱ������з���0.10 mol A��g������һ���¶Ƚ������·�Ӧ��A��g��  B��g����C��g������H����85.1 kJ��mol��1
B��g����C��g������H����85.1 kJ��mol��1
��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
 | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| c��A��/��mol��L��1�� | 0.10 | a | 0.026 | 0.0065 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������COCl2�������ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɡ�
��֪COCl2��g��??Cl2��g����CO��g������H����108 kJ��mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ����10 min��14 min��COCl2Ũ�ȱ仯����δʾ������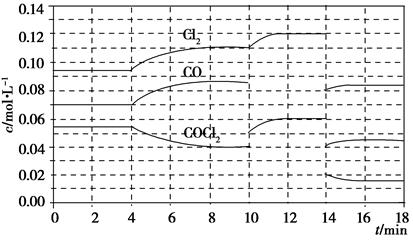
��1����ѧƽ�ⳣ������ʽK��________�����㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K��________��
��2���Ƚϵ�2 min��Ӧ�¶�T��2�����8 min��Ӧ�¶�T��8���ĸߵͣ�T��2��________T��8�������������������������
��3����12 minʱ��Ӧ���¶�T��8�������´ﵽƽ�⣬���ʱc��COCl2����________��10��12 min��CO��ƽ����Ӧ����Ϊv��CO����________��
��4���Ƚϲ���CO��2��3min��5��6min��12��13minʱƽ����Ӧ���ʣ�ƽ����Ӧ���ʷֱ���v��2��3����v��5��6����v��12��13�����Ĵ�С________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�ϲ����ұ���CO2����������Ҫ����ԭ�ϱ���ϩ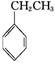 (g)+CO2(g)
(g)+CO2(g)
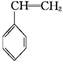 (g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(g)+CO(g)+H2O(g)����H="-166" kJ��mol-1
(1)���ұ���CO2��Ӧ��ƽ�ⳣ������ʽΪ:K=��������������������������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н���,����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬������������(�����)�� 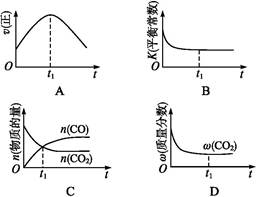
(2)��3 L�ܱ�������,�ұ���CO2�ķ�Ӧ�����ֲ�ͬ�������½���ʵ��,�ұ���CO2����ʼŨ�ȷֱ�Ϊ1.0 mol��L-1��3.0 mol��L-1,����ʵ�����T1��,0.3 MPa,��ʵ���ֱ�ı���ʵ����������;�ұ���Ũ����ʱ��ı仯��ͼ1��ʾ��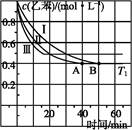
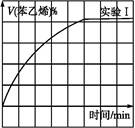
ͼ1 ͼ2
��ʵ����ұ���0~50 minʱ�ķ�Ӧ����Ϊ����������
��ʵ�����ܸı����������������������
��ͼ2��ʵ����б���ϩ�������V%��ʱ��t�ı仯����,����ͼ2�в���ʵ����б���ϩ�������V%��ʱ��t�ı仯���ߡ�
(3)��ʵ����н��ұ�����ʼŨ�ȸ�Ϊ1.2 mol��L-1,������������,�ұ���ת���ʽ���������(�������С�����䡱),�����ʱƽ�ⳣ��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ǵ����к����������壬�о������仯�������������Ҫ�����塣
��1���ϳɰ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3 (g) ��H=" -" 92.4kJ/mol
2NH3 (g) ��H=" -" 92.4kJ/mol
�ٽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬ƽ��ʱ���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
���¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
�������H2��ת���ʣ����д�ʩ���е��� ��
a���������а�ԭ�����ٳ���ԭ����
b�����������ٳ����������
c���ı䷴Ӧ�Ĵ���
d��Һ��������������
��2����2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) 2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��___________��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� _________��
a��v(NO2)=2v(O2)
b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2)
d�������ڵ��ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
��3������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
4CO(g)��2NO2(g) 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) 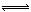 CH3OH(g)��
CH3OH(g)��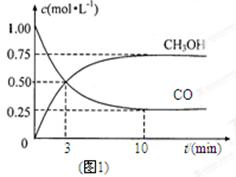
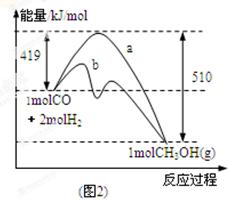
��1��ͼ1�DZ�ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯������ӷ�Ӧ��ʼ��ƽ�⣬��COŨ�ȱ仯��ʾƽ����Ӧ����v(CO)�� �� H2��ƽ��ת����Ϊ_________________________��
��2��ͼ2��ʾ�÷�Ӧ���й����������ı仯������a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������b��ʾʹ�ô�����������仯��д����Ӧ���Ȼ�ѧ����ʽ ��
��3�����¶��£���Ӧƽ�ⳣ��K��______________������ֵ�����¶����ߣ�ƽ�ⳣ��K_________(����������䡱��С��)��
��4�����������£����д�ʩ����ʹ��Ӧ��ϵ��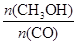 ����Ĵ�ʩ�� ��
����Ĵ�ʩ�� ��
a�������¶� b������He�� c���ٳ���2 molH2 d��ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ��ʾ��װ���з�����Ӧ2A2(g)+B2(g)2C(g)����H=" -a" kJ/mol��a ��0������֪P�ǿ����ɻ����Ļ���������ͬ�¶�ʱ�ر�K����A�� B�����зֱ����2mol A2��1mol B2�������ֱ���500��ʱ��ƽ�⣬A��C��Ũ��Ϊw1 mol/L���ų����� b kJ��B��C��Ũ��Ϊw2 mol/L���ų����� c kJ����ش��������⣺
��1���˷�Ӧ��ƽ�ⳣ������ʽΪ______________________�������¶����ߵ�700�棬��Ӧ��ƽ�ⳣ����_____________������С�䣩��
��2���Ƚϴ�С��w1_____ w2���������������a��b��c�ɴ�С�Ĺ�ϵ ______________________��
��3������K��һ��ʱ������´�ƽ�⣬����B�������______________________��������С�䣩��
��4������A��B�������ҹ̶�P����B�иij���4mol A2��2mol B2����500��ʱ��ƽ���C ��Ũ��Ϊw3 mol/L���� w1��w3�Ĺ�ϵ______________________��
��5����˵��A���Ѵﵽƽ��״̬���� ������ţ���һ������ѡ��������⣩��
a��v(C)=2v(B2)
b������������ѹǿ���ֲ���
c�������������ƽ����Է�����������ʱ����仯
d�������ڵ������ܶȱ��ֲ���
��6��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_____________��
a����ʱ�����C���� b���ʵ������¶�
c������B2��Ũ�� d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
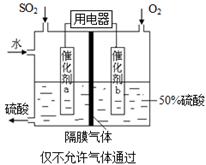
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��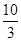 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
KI��Һ����������������������Ӧ����������ʵ���¼��
| ʵ���� | �� | �� | �� | �� | �� |
| �¶ȣ��棩 | 30 | 40 | 50 | 60 | 70 |
| ��ɫʱ�䣨s�� | 160 | 80 | 40 | 20 | 10 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com