
【题目】松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是
![]()
A. 分子式为C10H19O
B. 同分异构体可能属于醛类、酮类或酚类
C. 与氢气加成后的产物有4种一氯代物
D. 能发生取代、氧化、还原反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2(g)和I2(g)、H2(g)和I2(s)以及HI(g)的能量高低如图所示,下列判断错误的是( )
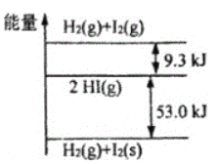
A.1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量
B.I2(g)→I2(s)+QkJ(Q>0)
C.H2(g)+I2(g)→2HI(g)+9.3kJ
D.H2(g)+I2(s)→2HI(g)+53.0kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
C.混合溶液的pH=7
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂让汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:__________
(2)到了冬季,我国北方烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g)![]() 2NO(g) ΔH1= +180.5 kJmol-1
2NO(g) ΔH1= +180.5 kJmol-1
② CO(g)![]() C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
③ C (s)+O2(g)![]() CO2(g) ΔH3= -393.5 kJmol-1
CO2(g) ΔH3= -393.5 kJmol-1
则ΔH=_____________kJmol-1。
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:______________________________________。
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
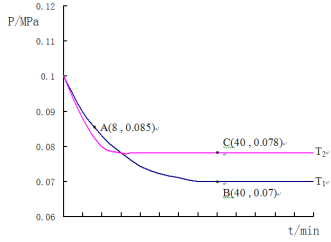
①该反应的化学平衡常数表达式:K=__________________。
②图中A点时,SO2的转化率为________________
③计算SO2催化氧化反应在图中B点的压强平衡常数K=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) ____vA(逆) (填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
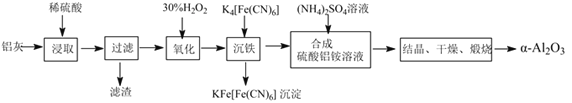
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com