
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
| m |
| M |
| 7.1g |
| 71g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、分馏、干馏、裂化都是化学变化 |
| B、聚乙烯、聚氯乙烯、纤维素都是合成高分子 |
| C、硫酸铜、醋酸、铁都是电解质 |
| D、盐酸、漂白粉、铝热剂都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| B、该过程破坏了ZnS的溶解平衡 |
| C、白色沉淀为ZnS,而黑色沉淀为CuS |
| D、上述现象说明ZnS的Ksp小于CuS的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
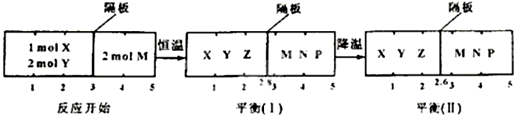
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
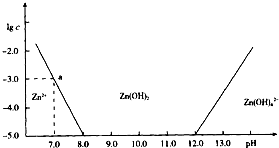 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.| c(HCl)(mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)(mol?L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com