
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 45g |
| 18g/mol |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
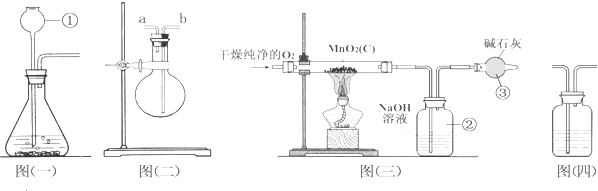
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 17.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究 (Ⅲ)实验①和④探究 |
| ② | 25 | 粗颗粒 | A | |
| ③ | B | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 元素的性质、用途或原子结构信息 |
| Q | 原子核外有6个电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液常用作肥料,呈弱碱性 |
| Y | 第三周期元素的简单阴离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸和丙氨酸缩合最多可形成4种二肽 |
| C、分子式为C4H6O2,既能与NaOH溶液反应又能与溴的四氯化碳溶液反应的有机物有4种 |
D、乳酸薄荷醇酯( )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com