
【题目】【选修5——有机化学基础】
某新型有机化学材料G的合成路线如图所示,请回答下列问题:
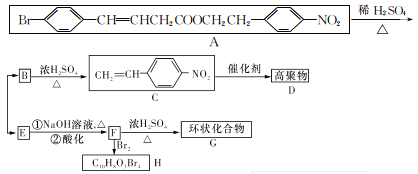
(1)F分子中的含氧官能团名称为_______。
(2)高聚物D的结构简式是_______。
(3)写出反应A→B+E的化学方程式:________。
(4)F→H的反应类型有______、_________。
(5)B的同分异构体有多种,其中官能团种类不变,能与FeCl3溶液发生显色反应,核磁共振氢谱显示有6组峰,且峰面积之比为1:1:1: l:2:3的同分异构体有_____种。
(6)参照上述合成路线,以CH3CHBrCOOCH3为原料(无机试剂任选),设计制备聚乳酸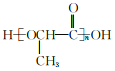 的合成路线_____________________。
的合成路线_____________________。
【答案】 羟基、羧基 
![]() +H2O
+H2O![]()
![]() +
+![]() 加成反应 取代反应 (顺序可互换) 20
加成反应 取代反应 (顺序可互换) 20 
【解析】本题主要考查有机物的结构与性质。
(1)A→B+E发生酯的水解反应,E含有羧基和溴原子,E→F发生溴原子与羟基的取代反应,因此,F分子中的含氧官能团名称为羟基、羧基。
(2)高聚物D是C的加聚产物,D的结构简式是 。
。
(3)反应A→B+E发生酯的水解反应,反应的化学方程式:![]() +H2O
+H2O![]()
![]() +
+![]() 。
。
(4)F→H发生碳碳双键与溴的加成反应和酚与溴的取代反应,反应类型有加成反应、取代反应。
(5)B为![]() ,B的同分异构体能与FeCl3溶液发生显色反应,表明该物质含有酚羟基,核磁共振氢谱显示有6组峰,且峰面积之比为1:1:1:1:1:2:3,表明该物质含有6种氢原子,且6种氢原子数目之比为1:1:1:1:2:3。符合上述条件的该物质的分子结构中,苯环侧链为—CH2CH3、—OH、—NO2的有10种,苯环侧链为—CH2NO2、—CH3、—OH的有10种,共20种。
,B的同分异构体能与FeCl3溶液发生显色反应,表明该物质含有酚羟基,核磁共振氢谱显示有6组峰,且峰面积之比为1:1:1:1:1:2:3,表明该物质含有6种氢原子,且6种氢原子数目之比为1:1:1:1:2:3。符合上述条件的该物质的分子结构中,苯环侧链为—CH2CH3、—OH、—NO2的有10种,苯环侧链为—CH2NO2、—CH3、—OH的有10种,共20种。
(6)以CH3CHBrCOOCH3为原料(无机试剂任选),制备聚乳酸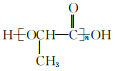 的合成思路:将CH3CHBrCOOCH3水解为CH3CHBrCOOH,再水解为CH3CHOHCOOH,最后缩聚为聚乳酸。合成路线:
的合成思路:将CH3CHBrCOOCH3水解为CH3CHBrCOOH,再水解为CH3CHOHCOOH,最后缩聚为聚乳酸。合成路线: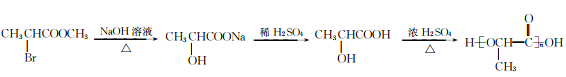 。
。


科目:高中化学 来源: 题型:
【题目】下列有关生铁炼钢的叙述错误的是( )。
A.添加必要的元素,改善钢材的组织结构和性能
B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
D.除去生铁中的非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的实验操作、现象及结论描述正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32– |
C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种元素分别是元素周期表中连续 3 个短周期的元素,且原子序数 依次增大.X、W 同主族,Y、Z 为同周期的相邻元素.W 原子的质子数等于 Y、Z 原子最 外层电子数之和.Y 与 X 形成的分子中有 3 个共价键.Z 原子最外层电子数是次外层电子 数的 3 倍.试推断:
(1)Z 离子的结构示意图 .
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式 为;含有离子键和共价键的化合物的化学式为 .
(3)由 X、Y、Z 所形成的常见离子化合物是 (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为 .
(4)用电子式表示W与Z形成W2Z化合物的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3——物质结构与性质】
铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是_________________。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
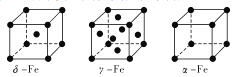
①δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为_____g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为__________。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
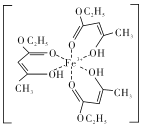
①此配合物中,铁离子的价电子排布式为_________。
②此配合物中碳原子的杂化轨道类型有_______。
③此配离子中含有的化学键有_____(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G. δ键 H.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如下图所示:

有关信息如下:
①反应原理:TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g)。
TiCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F中有氮气生成,该反应的化学方程式为_______________________。
(2)实验装置依次连接的顺序为F→B→______。
(3)实验开始前首先点燃____处(填“D”或“F”)酒精灯,目的是______________。
(4)E装置不能换成B装置,理由是______________。
(5)欲分离装置C中的液态混合物,所采用操作方法的名称是______________。
(6)TiCl4是制取航天航空工业材料钛合金的重要原料。某钛合金含有的元素还有Al和Si等。已知在常温下,钛是一种耐强酸、强碱的金属,请设计实验检验其中的Si元素________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com