
分析 (1)先计算H2O2的质量,然后代入2H2O2═2H2O+O2↑计算产生氧气的质量;
(2)反应后所得溶液的质量为20g-0.8g+10.8g,CuSO4的质量仍为0.75g,代入ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算.
解答 解:(1)20g质量分数为8.5%的过氧化氢溶液中含有H2O2的质量为20g×8.5%=1.7g,
设生成氧气的质量为x.
2H2O2═2H2O+O2↑
68 32
1.7g x
$\frac{68}{1.7g}=\frac{32}{x}$,x=0.8g,
答:产生氧气的质量为0.8g;
(2)反应后所得溶液的质量为20g-0.8g+10.8g=30g,CuSO4起催化作用,质量仍为0.75g,
反应后所得硫酸铜溶液的溶质质量分数ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{0.75g}{30g}$×100%=2.5%,
答:反应后所得溶液中CuSO4的质量分数为2.5%.
点评 本题考查化学方程式及溶液中溶质的质量分数的计算,题目难度中等,注意催化剂在反应前后质量和化学性质不变.


科目:高中化学 来源: 题型:填空题
 可简写为
可简写为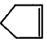 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: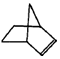
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
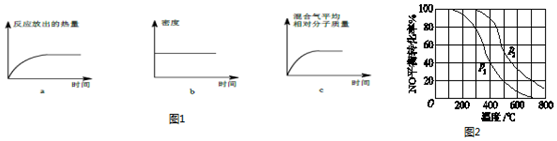
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
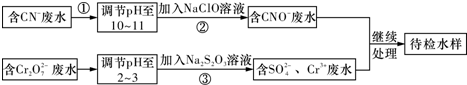
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
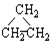 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中有晶体析出,Na+数目不变 | |
| B. | 溶液中的OH- 物质的量浓度不变,有O2放出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液中NaOH的浓度减小,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O中含有的质子数、中子数均为NA | |
| B. | 标准状况下,22.4 L CCl4含有NA个CCl4分子 | |
| C. | 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com