
【题目】用NA表示阿伏加德罗常数的值.下列说法中正确的是
A.5.6 g Fe和足量的氯气完全反应失去电子数为0.2NA
B.标准状况下,11.2L CCl4所含的分子数为0.5NA
C.0.5 molL﹣1AlCl3溶液中Cl﹣的数目为1.5NA
D.17g氨气中含有的电子数为10NA
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
A. 分液 B. 蒸馏 C. 过滤 D. 蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组热化学方程式中,有关ΔH的比较正确的是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) ΔH3
Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4 B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4 D.ΔH1<ΔH2;ΔH3<ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是生产氮肥、尿素等物质的重要原料。
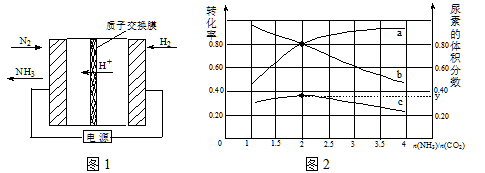
(1)合成氨反应N2(g)+ 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是_____________。
②用NaClO溶液也可将废水中的NH4+ 转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液 L。
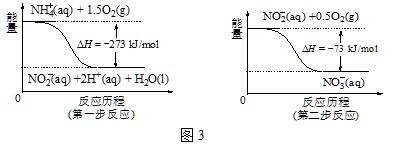
③在微生物的作用下,NH4+ 经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+ (aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
④用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液的工艺流程如下:
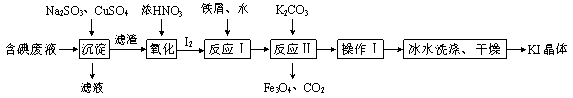
(1)“沉淀”中生成CuI的离子方程式为 。
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为 ,分析原因___________。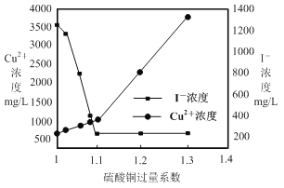
(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),反应Ⅱ的化学方程式是_________。
(4)操作Ⅰ包括 ,冰水洗涤的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
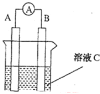
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com