
| 物质 | AgNO3 | Ba(OH)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 35.8 | |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A、2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 |
| B、2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C、2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 |
| D、2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |


科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
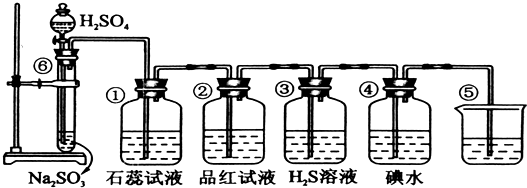
查看答案和解析>>
科目:高中化学 来源: 题型:
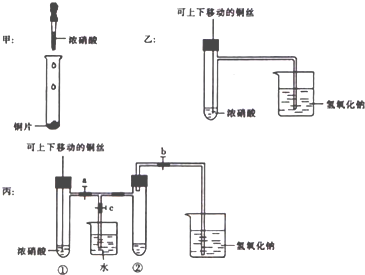
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
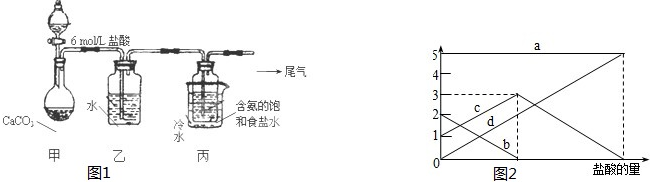
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com