
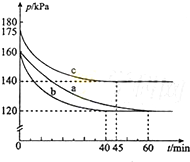
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;| △c |
| △t |
| 120KPa |
| 160KPa |
| n |
| 0.4mol |
| 0.10mol |
| 10L×60min |
| 0.10mol |
| 10L×60min |
| po |
| p |
| 0.4 |
| n |
| 0.4p |
| po |
| 0.4p |
| po |
0.4-
| ||
| 0.2 |
| p |
| p0 |
| p |
| p0 |
| 120 |
| 160 |
| 140 |
| 175 |
| p |
| p0 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
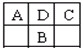 A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、D元素形成的单质不止一种 |
| D、C的氢化物水溶液通常用玻璃试剂瓶盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有Cu2+、肯定无 |
肯定无该离子的理由 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g固体; | Cu2+物质的量浓度 为 |
Cu元素守恒 |
| 步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀. | 肯定有Cl-、 肯定无Ba2+. |
肯定有Cl-的理由 |
查看答案和解析>>
科目:高中化学 来源: 题型:
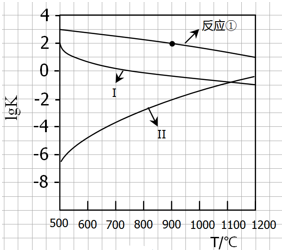 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 实验操作 | 实验现象或数据 | 结 论 | ||
| 甲 | ①向a g M中加入一定量稀硫酸,充分搅拌; ②继续滴加稀硫酸至过量,充分反应. |
①固体明显减少; ②仍然有一定量固体,溶液呈蓝色 |
①M中一定有Cu2O; ②M中一定有Cu. | ||
| 乙 | ①将甲实验后所得溶液过滤 ②将滤渣洗涤、干燥、称量 |
滤渣质量为
|
M为Cu和Cu2O的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B、制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com