
【题目】对于氯化钠晶体,下列描述正确的是( )
A.它是六方紧密堆积的一个例子
B.58.5g氯化钠晶体中约含6.02×1023个NaCl分子
C.与氯化铯晶体结构相同
D.每个Na+与6个Cl-作为近邻
科目:高中化学 来源: 题型:
【题目】“无论从经济的发展还是人类的进步而言,合成氨的发明都是本世纪科学领域中最辉煌的成就之一.”图1是与NH3相关的工业过程示意图. 
已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJmol﹣1
(1)请写出CH4(g)与O2(g)反应生成CO(g)和H2(g)的热化学反应方程式 .
(2)在生产过程中,会涉及H2和CO2的分离.你认为可取的方法是(填序号).
a.在加压条件下用水吸收CO2 b.用NaOH溶液吸收CO2 c.加压,使CO2液化
(3)合成尿素的反应是分作两步进行的:
①CO2(g)+2NH3(g)═H2NCOONH4(aq) (氨基甲酸铵)△H=﹣159.47kJmol﹣1
②H2NCOONH4(aq)═CO(NH2)2(aq)+H2O(l)△H=﹢28.49kJmol﹣1
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图2所示.生产过程中n(NH3):n(CO2)的最佳配比为 , 而实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为、 . 在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是 .
(4)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3 . 若HNO3与NH3的反应是完全的,有标准状况下50LNH3经上述反应过程生成84g NH4NO3 . 则NH3逐级转化为HNO3的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由于物质的漂白性而导致溶液褪色的是( )
①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色
②将活性炭放入红墨水中,溶液褪色
③向品红溶液中滴加氯水,红色褪去
④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去
A.①③
B.①②③
C.①②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是(填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8e-稳定结构的物质可能是(写分子式)。元素⑨和⑩形成的化合物的化学式为;元素①的原子价电子排布式是。
(3)①、⑥、⑦、⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是(填名称),可以验证你的结论的是下列中的(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界中的存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题。
(1)A和D的氢化物中,沸点较低的是(选填“A”或“D”);A和B的离子中,半径较小的是(填离子符号)。
(2)元素C在元素周期表中的位置是。
(3)A和E可组成离子化合物,其晶胞结构如上图所示,阳离子(用“”表示)位于该正方体的顶点和面心,阴离子(用“o”表示)均位于小正方体中心。该化合物的电子式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2 , 反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为
②下列选项能判断该反应达到平衡状态的依据的有
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣akJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=﹣bklmol﹣1
③H2O(g)=H2O(1)△H=﹣ckJmol﹣1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=kJmol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为 .
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同 体积的NH3和H2S气体的质量之比为______________;同质量的NH3和H2S气体的体积之比为________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2 , 至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.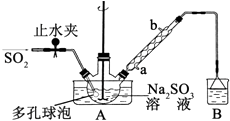
(1)装置B 的烧杯中应加入的溶液是;冷凝管中冷却水从(填“a”或“b”)口进水.
(2)A中多孔球泡的作用是 .
(3)冷凝管中回流的主要物质除H2O 外还有(填化学式).
(4)写出步骤2中发生反应的化学方程式 .
(5)步骤3中在真空容器中蒸发浓缩的原因是 .
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com