
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:

(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反 应产生新的杂质,相关的化学方程式为①____________________和②_____________________。
应产生新的杂质,相关的化学方程式为①____________________和②_____________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有______;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在______。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为________________________________________________________________________。
(4)镀铝电解池中,金属铝为______极。熔融盐电镀液中铝元素和氯元素主要以AlCl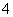 和Al2Cl
和Al2Cl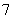 形式存在,铝电极的主要电极反应式为______________________________________。
形式存在,铝电极的主要电极反应式为______________________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是_______________________________________________________________________。
答案 (1)①2Al+Fe2O3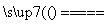 Al2O3+2Fe
Al2O3+2Fe
②4Al+3SiO2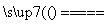 2Al2O3+3Si
2Al2O3+3Si
(2)HCl和 AlCl3 NaCl
AlCl3 NaCl
(3)Cl2+2OH-===Cl-+ClO-+H2O,H++OH-===H2O
(4)阳 Al+4Cl--3e-===AlCl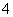 ,2Al+7Cl--6e-===Al2Cl
,2Al+7Cl--6e-===Al2Cl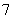
(5)致密的氧化铝膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生
解析 (1)铝属于活泼金属,在高温下可置换某些金属或非金属,因此有关反应的方程式为
2Al+Fe2O3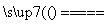 Al2O3+2Fe、4Al+3SiO2
Al2O3+2Fe、4Al+3SiO2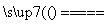 2Al2O3+3Si。
2Al2O3+3Si。
(2)在高温下,氯气可与氢气、金属钠和铝反应生成HCl、NaCl和AlCl3,由于温度是700 ℃,所以AlCl3会升华变成气体,因此气泡的主要成分除Cl2外还含有HCl和AlCl3;NaCl熔点为801 ℃,此时NaCl不会熔化,只能在浮渣中存在,即浮渣肯定存在NaCl。
(3)尾气经冷凝后分为气体A和B,由框图可知A是氯气和氯化氢的混合气体,B是AlCl3,因此用废碱液处理A的过程中,所发生反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O和H++OH-===H2O。
(4)既然是镀铝 ,所以铝必须做阳极,由于熔融盐中铝元素和氯元素主要以AlCl
,所以铝必须做阳极,由于熔融盐中铝元素和氯元素主要以AlCl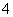 和Al2Cl
和Al2Cl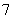 形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl
形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl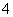 ;2Al+7Cl--6e-===Al2Cl
;2Al+7Cl--6e-===Al2Cl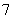 。
。
(5)铝在空气中易形成一层极薄的致密而坚固的氧化膜,它能阻止内部的金属继续被氧化,起到防腐蚀保护作用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
| B | AlCl3溶液中滴加过量的氨水溶液 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
| C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
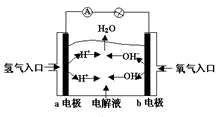
A. a电极是负极
B. b电极的电极反应为:4OH--4e-==2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验设计能够达到目的的是 ( )。
| 选项 | 实验目的 | 实验设计 |
| A | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
|
| 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是 ( )。
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的工业制法中正确的是( )
A.制钛:用金属钠置换氯化钛(TiCl4)水溶液中的钛
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁
C.制钠:以海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO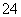 等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
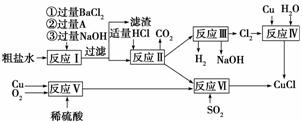
(1)A的化学 式为________。
式为________。
(2)写出反应Ⅴ的化学方程式________________________________________________
________________________________________________________________________。
(3)写出反应Ⅵ的离子方程式_____________________________________________
________________________________________________________________________。
(4)本工艺中可以循环利用的物质是(用化学式表示)_______________________________
________________________________________________________________________。
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃ 干燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_______
干燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_______ ____________
____________
___________________________________ ___________________
___________________ __________________。
__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 在水中加入氢氧化铁固体,再加热就可制备氢氧化铁胶体
B. 鉴别溶液与胶体较简便的方法是用激光束照射
C. 蒸发操作时,应使混合物中的水分完全蒸干后,才停止加热
D. Na2CO3俗名纯碱,所以Na2CO3是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质均为只含两种元素的化合物,且均含18个电子。下列有关这四种物质的推断,正确的是( )
A.可能在某种物质中含有离子键 B.四种物质都是共价化合物
C.四种物质都不可能具有强氧化性 D.有一种物质是乙烷的 同系物
同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com